
- •40. Равновесное излучение и его свойства. Закон Стефана-Больцмана. Формула Вина и закон смещения Вина. Формула Рэлея-Джинса.
- •Формула Релея-Джинса:
- •41. Гипотеза Планка и формула Планка. Квантовая теория равновесного излучения. Понятие об оптической пирометрии.
- •43. Гипотеза Эйнштейна о фотонах. Опыт Боте. Энергия и импульс фотона. Корпускулярно-волновой дуализм свойств света.
- •- Формула Эйнштейна.
- •Опыт Боте и импульс фотона. (рис)
- •Корпускулярно волновой дуализм света.
- •45. Эффект Комптона. Теория эффекта Комптона. Электроны отдачи.
- •Опыты показали, что:
- •48. Тормозное рентгеновское излучение. Коротковолновая граница сплошного рентгеновского спектра.
- •50. Модели атомов. Опыты Гейгера и Марсдена. Рассеяние -частиц. Опыты Резерфорда. Размеры атомов и ядер.
- •51. Эмпирические закономерности в спектрах атома водорода. Спектральные серии. Элементарная теория Бора водородоподобного иона. Энергетические уровни атома водорода и его спектры.
- •- Уравнение движения. – правило квантования орбит.
- •Подробное исследование спектра атома водорода.
- •Спектральные закономерности.
- •52. Опыт Франка-Герца. Учет движения ядра.
- •Опыт Франка-Герца
- •54. Соотношения неопределенностей Гейзенберга. Корпускулярно-волновой дуализм. Применение соотношения неопределенностей Гейзенберга.
- •55. Магнитный момент атома. Опыты Штерна и Герлаха. Гипотеза Гаудсмита и Уленбека. Спин и собственный магнитный момент электрона. Понятие о принципе Паули.
- •58. Резонансное усиление света.
- •59. Условия стационарной генерации (баланс фаз и баланс амплитуд).
- •Условие порога генерации:
- •60. Устройство и принцип работы лазеров. Роль оптического резонатора. Продольные и поперечные моды. Спектральный состав излучения лазеров. Применение лазеров.
- •Продольные и поперечные моды
50. Модели атомов. Опыты Гейгера и Марсдена. Рассеяние -частиц. Опыты Резерфорда. Размеры атомов и ядер.
Рассеяние -частиц.
Суть опыта состояла в следующем: (РИС)
α частица
 : q=|e|,
: q=|e|,

Было обнаружено рассеяние частиц практически во всех диапазонов углов θ. Основная масса рассеивалась в пределах 1-3۫. α частица первого порядка (из 20.000) рассеивалась на угол θ=180۫.
Из этих результатов следовало, что значительное отклонение связанно с взаимодействием α частицы с положительным зарядом, большей массы.
Ядерная планетарная модель атома Резерфорда 1911г.:
Весь положительный заряд сосредоточен в области называемой ядром:

радиус
ядра: м;
м;
радиус
атома: =
=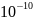 м;
м;
Масса ядра:
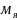 =99,96
=99,96
Остальная часть – облако электронов, которые движутся по орбитам. Атом электронейтрален.
Резерфорд выстроил теорию, согласно, которой: (РИС)
в- прицельный параметр.
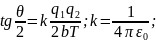
 – Формула Резерфорда.
– Формула Резерфорда.
n – число ядер фольги находящихся на единице площади поверхности;
 – телесный угол, в котором рассматривается
рассеяние α частиц;
– телесный угол, в котором рассматривается
рассеяние α частиц;
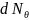 – число частиц рассеянных под углом θ
в пределах
– число частиц рассеянных под углом θ
в пределах
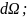
N- Общее число частиц падающих на фольгу;
Т – кинетическая энергия α частиц.
Формула
Резерфорда определяет относительное
число частиц рассеянных под углом θ в
пределах телесного угла

Трудности, испытывающие модель:
1)Электрон
должен упасть на ядро за t∼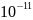 с
растратив свою энергию на получение
движения с ускорением.
с
растратив свою энергию на получение
движения с ускорением.
2)Спектр должен быть непрерывным.
В 1913г. Нильс Бор предпринял первую попытку построить квантовую теорию атома. Цель модели: требовалось связать в единое целое эллиптические закономерности линейчатых спектров ядерной модели Резерфорда, квантовую модель излучения и поглощения света.
Атом может длительное
время находиться в стационарном
состоянии, которое характеризуется
дискретными значениями энергии:
 .
В этих состояниях вопреки классической
электродинамике атом не излучает.
.
В этих состояниях вопреки классической
электродинамике атом не излучает.
51. Эмпирические закономерности в спектрах атома водорода. Спектральные серии. Элементарная теория Бора водородоподобного иона. Энергетические уровни атома водорода и его спектры.
Постулаты Бора позволили рассчитать спектр атома водорода и водородоподобного состояния, т.е. система состоит из ядра с зарядом z|e| и одного электрона. Движение по орбите происходит за счёт Кулоновских сил. (РИС)
- Уравнение движения. – правило квантования орбит.
⟹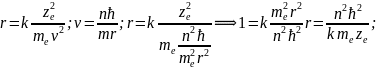

 -
первый Боровский радиус.
-
первый Боровский радиус.
2)
 -
полная энергия.
-
полная энергия.


Описания уравнения энергии в стационарном состоянии электрона в водородоподобной системе. знак «-« указывает на то, что электроны находятся в связанном состоянии. Число n – главное квантовое число, если n=1 – это есть основное состояние при n->∞ уровни энергии сгущаются.
Подробное исследование спектра атома водорода.
В
УФ области:
 -
Серия Лаймона.
-
Серия Лаймона.
В
ИК области: -
Серия Пашена.
-
Серия Пашена.
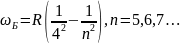 -
Серия Брэкета.
-
Серия Брэкета.
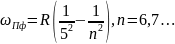 -Серия
Пфунда.
-Серия
Пфунда.
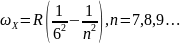 -
Серия Хэмфри.
-
Серия Хэмфри.
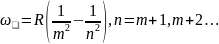 -
общая формула Бальмера.
-
общая формула Бальмера.
Замечание: За границей серии спектр не обрывается, становится сплошным.
Спектральные закономерности.
В атомных спектрах отдельные линии расположены не беспорядочно, образовывая группы (серии) линий. (РИС)
В 1825г. Бальмер обнаружил закономерность:
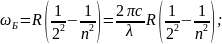
Определённое расположение линий в
видимой её области. n=3,4,5…λ
нм; R=2,07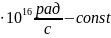 Ритберга.
Ритберга.
