
- •Начала химии
- •Астрахань
- •1. Химические знаки и атомные массы элементов
- •Химические знаки и атомные массы важнейших элементов
- •2. Распространённость химических элементов
- •Распространённость химических элементов
- •3. Формы существования химических элементов
- •Формы существования химических элементов
- •4. Вещества молекулярного и немолекулярного строения
- •5. Структурные изменения веществ
- •Вещества молекулярного и немолекулярного строения
- •Структурные изменения веществ
- •6. Способы разделения смесей
- •Способы разделения смесей
- •7. Химические знаки и формулы
- •Химические знаки (символы) и формулы
- •8. Составление химических формул по валентности атомов элементов
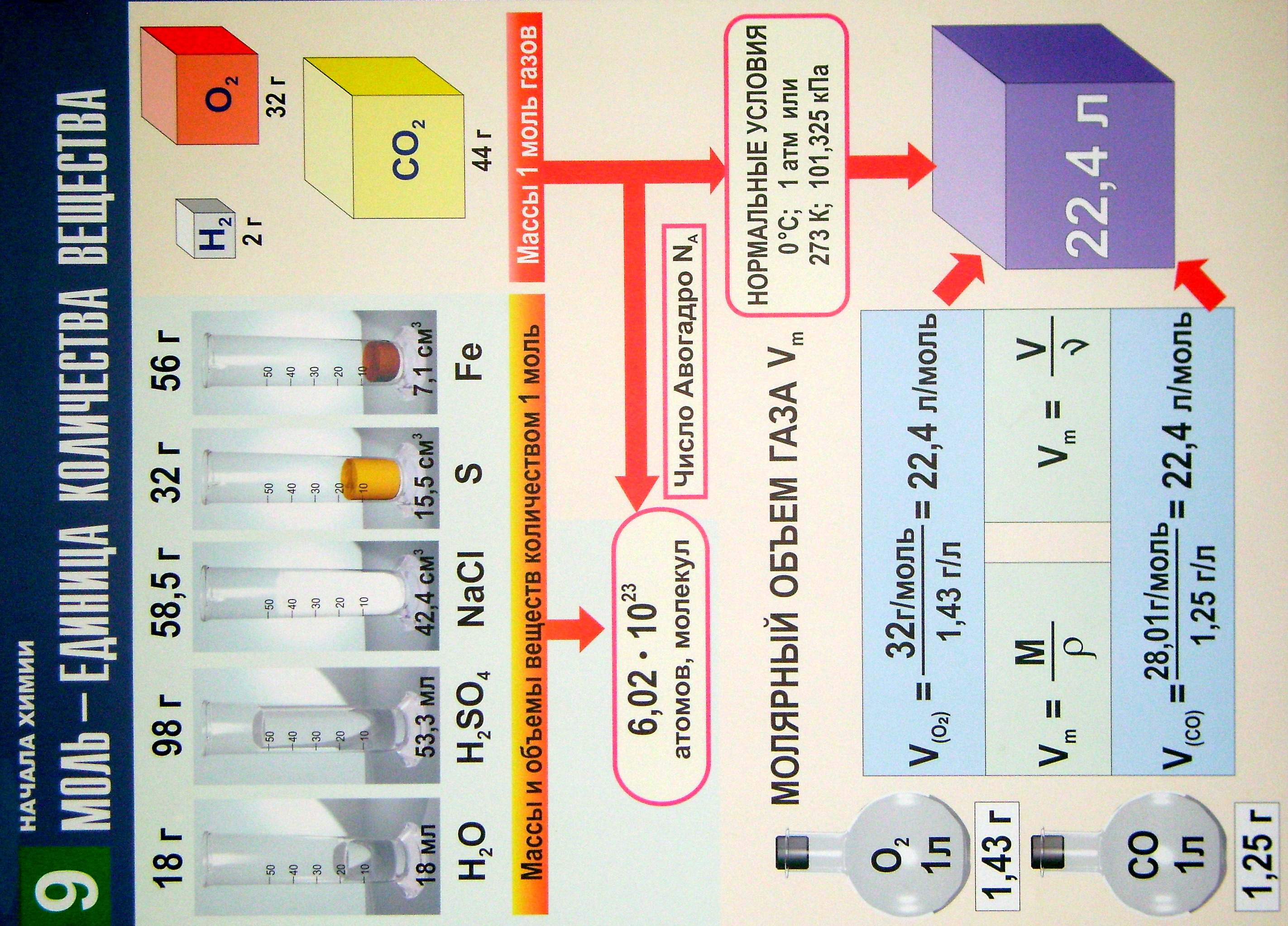
- •9. Моль – единица количества вещества
- •Составление химических формул по валентности атомов элементов
- •Моль – единица количества вещества
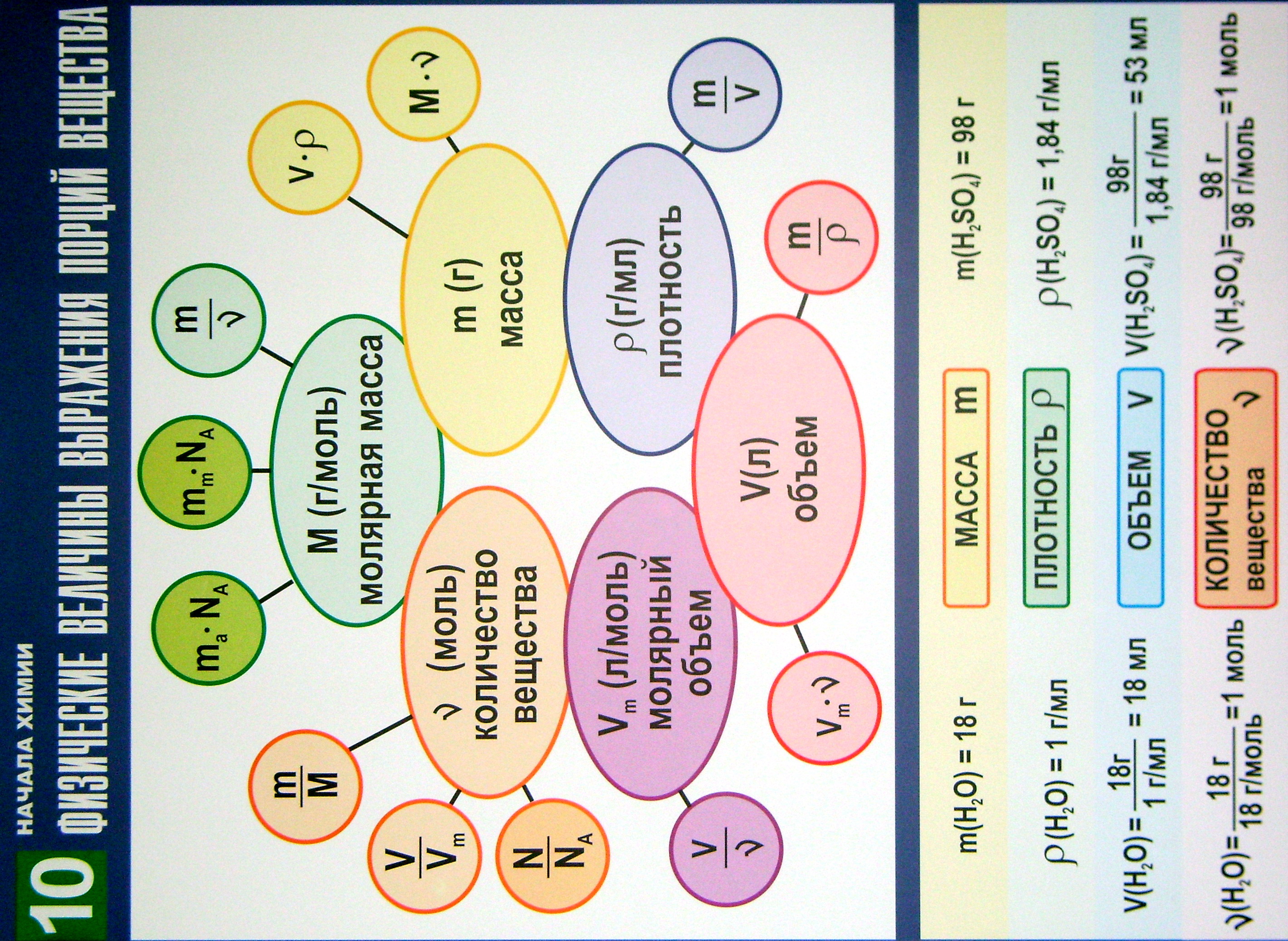
- •10. Физические величины выражения порций вещества
- •Исходные формулы и расчёты на их основе массы, объёма и количества вещества
- •Физические величины выражения порций вещества
- •11. Признаки и условия течения химических реакций
- •Признаки и условия течения химических реакций
- •12. Типы химических реакций
- •Типы химических реакций
- •13. Воздух. Кислород. Горение
- •Воздух. Кислород. Горение
- •14. Строение и характеристика пламени
- •Строение и характеристика пламени
- •15. Составление химических формул солей
- •Составление химических формул солей
- •16. Генетическая связь классов неорганических веществ
- •Генетическая связь классов неорганических веществ
- •Величины и единицы измерения
- •Основные единицы си
- •Приставки для обозначения кратных и дольных единиц от единиц си
- •Важнейшие физические постоянные
- •Обозначения, используемые в химии
- •Оборудование и посуда для химического эксперимента
- •Начала химии
Моль – единица количества вещества
10. Физические величины выражения порций вещества
В таблице 10 приведены формулы для расчёта основных физических величин: массы, молярной массы, объёма и количества вещества. Эти расчёты необходимы для решения задач, которые основываются на взаимной связи физических величин и химических формул. При этом важно, чтобы единицы используемых величин были согласованы.
Расчёт массы вещества. В химии под веществом обычно понимается определённая совокупность атомных или молекулярных (структурных) частиц.
Расчёт массы вещества, если известны его молярная масса и количество вещества , производят по формуле:
m = М · ν,
где ν – количество вещества1, М – его молярная масса.
Исходные формулы и расчёты на их основе массы, объёма и количества вещества
Исходная формула |
Масса (m), г (кг) |
Объём (V), см3 (мл), дм3 (л), м3 |
Количество вещества (ν), моль (кмоль) |
Молярная масса
М =
г/моль (кг/кмоль) |
m = М · ν |
|
ν =
|
Молярный объём2
VМ
=
дм3/моль ( л/моль), м3/кмоль |
|
V = VМ · ν |
ν =
|
Плотность вещества
ρ =
г/см3 (г/мл), кг/л |
m = V · ρ |
V =
|
|
Таблица 10
Физические величины выражения порций вещества
Эта формула следует из определения молярной массы – массы одного моля – величин, равной отношению массы порции вещества к количеству вещества в этой порции.
Расчёт массы вещества, если известны его объём и плотность, производят по формуле
m = V · ρ,
где V – объём вещества, ρ – его плотность.
Эта формула следует из определения плотности – величины, определяемой для однородного вещества его массой в единице объёма.
Расчёт количества вещества. Физическая величина, характеризующая число структурных единиц (атомов, молекул, ионов, протонов, электронов) в порции вещества, называется количеством вещества. В Международной системе единиц1 единицей количества вещества является моль.
Применяя понятие "количество вещества", в каждом конкретном случае следует указывать, о каких структурных единицах идёт речь. Например, выражение "один моль водорода" не является однозначным, поскольку из него не ясно, имеется ли в виду один моль атомов водорода Н или один моль молекул водорода Н2.
Расчёт количества вещества, если известны его масса и молярная масса, производят по формуле
ν = ,
где m – масса вещества, М – его молярная масса.
Эта формула следует из определения молярной массы.
Расчёт количества вещества газообразного вещества, если известны его объём и молярный объём, производят по формуле
ν = ,
где V – объём газообразного вещества, VМ – его молярный объём.
Эта формула следует из определения молярного объёма – объём одного моля – величины, равной отношению объёма порции вещества к количеству вещества в этой порции.
Объём и молярный объём газа должны быть измерены при одинаковых температуре и давлении.
Расчёт количества вещества можно осуществить через число молекул:
ν =
![]() .
.
где NА – постоянная (число) Авогадро (6,02 ·1023 моль–1).
Расчёт объёма вещества, если известны его масса и плотность, производят по формуле
V = .
Эта формула следует из определения плотности.
Расчёт объём вещества в любом агрегатном состоянии если известны количество этого вещества и его молярный объём, производят по формуле:
V = VМ · ν
Эта формула следует из определения молярного объёма.
Расчёт молярной массы вещества, если известны масса и количество этого вещества производят по формуле:
М =
![]() .
.
Расчёт молярной массы атомов элемента, а также простого или сложного вещества производят по известной массе атомных или молекулярных частиц
М = mа · NА ; М = mm · NА,
где mа – масса атома данного химического элемента (г),
mm – масса молекулы данного вещества,
NА – число Авогадро.
