
- •Начала химии
- •Астрахань
- •1. Химические знаки и атомные массы элементов
- •Химические знаки и атомные массы важнейших элементов
- •2. Распространённость химических элементов
- •Распространённость химических элементов
- •3. Формы существования химических элементов
- •Формы существования химических элементов
- •4. Вещества молекулярного и немолекулярного строения
- •5. Структурные изменения веществ
- •Вещества молекулярного и немолекулярного строения
- •Структурные изменения веществ
- •6. Способы разделения смесей
- •Способы разделения смесей
- •7. Химические знаки и формулы
- •Химические знаки (символы) и формулы
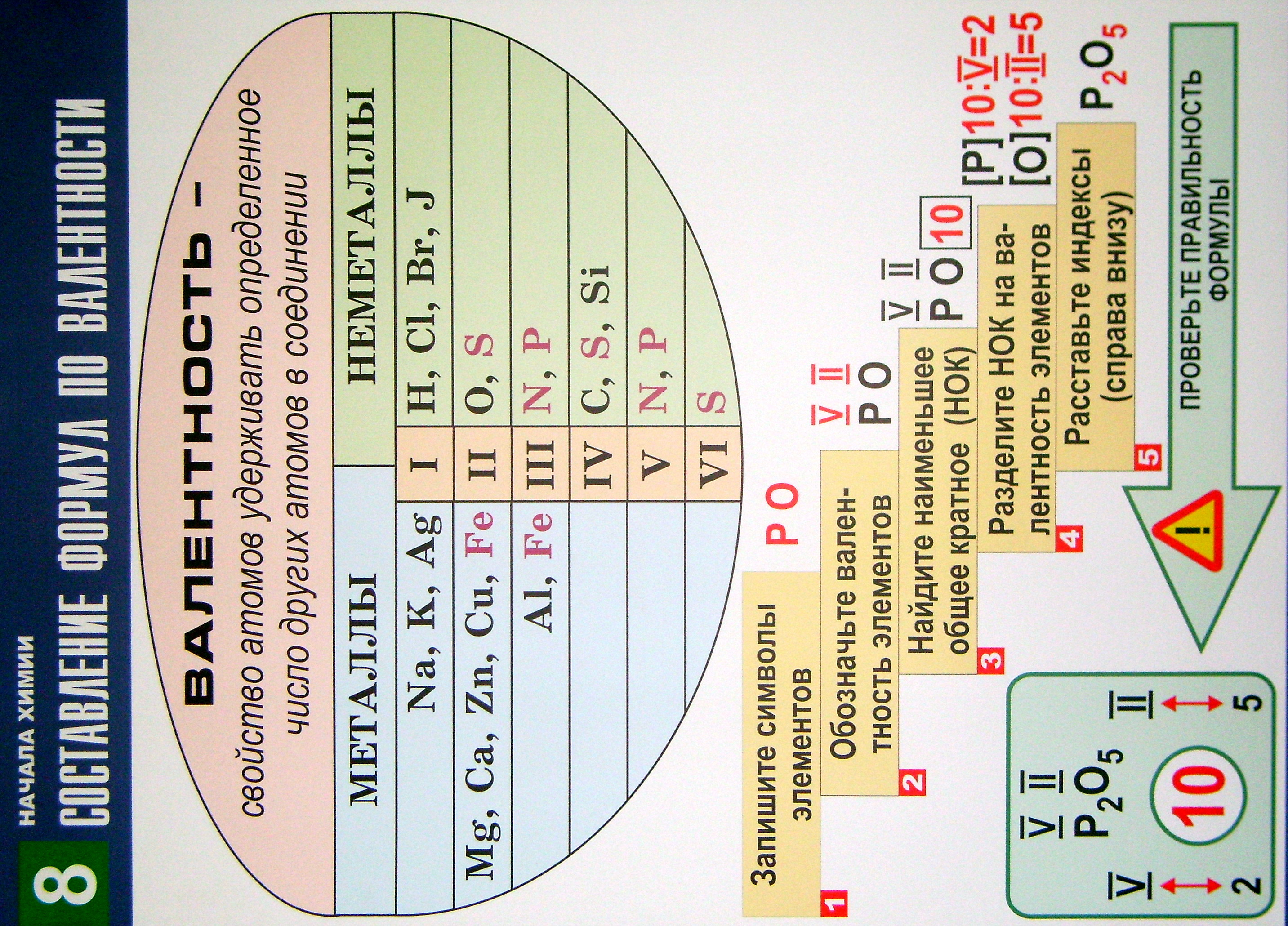
- •8. Составление химических формул по валентности атомов элементов
- •9. Моль – единица количества вещества
- •Составление химических формул по валентности атомов элементов
- •Моль – единица количества вещества
- •10. Физические величины выражения порций вещества
- •Исходные формулы и расчёты на их основе массы, объёма и количества вещества
- •Физические величины выражения порций вещества
- •11. Признаки и условия течения химических реакций
- •Признаки и условия течения химических реакций
- •12. Типы химических реакций
- •Типы химических реакций
- •13. Воздух. Кислород. Горение
- •Воздух. Кислород. Горение
- •14. Строение и характеристика пламени
- •Строение и характеристика пламени
- •15. Составление химических формул солей
- •Составление химических формул солей
- •16. Генетическая связь классов неорганических веществ
- •Генетическая связь классов неорганических веществ
- •Величины и единицы измерения
- •Основные единицы си
- •Приставки для обозначения кратных и дольных единиц от единиц си
- •Важнейшие физические постоянные
- •Обозначения, используемые в химии
- •Оборудование и посуда для химического эксперимента
- •Начала химии
9. Моль – единица количества вещества
Таблица 9 наглядно представляет понятие – "количество вещества", знакомит с молярной массой и молярным объёмом веществ в различных агрегатных состояниях, а также с числом Авогадро.
Понятие молярной массы используется по отношению к атомам химических элементов, простым веществам и химическим соединениям с молекулярным и немолекулярным строением.
Таблица 8
Составление химических формул по валентности атомов элементов
В мерных цилиндрах, изображённых в верхнем ряду таблицы, находятся твёрдые и жидкие вещества разной массы, однако количество вещества в них одинаково и равно 1 моль. В каждом из этих цилиндров находится одинаковое число структурных единиц – 6,02 · 1023 (число, или постоянная Авогадро).
Для жидких и твёрдых веществ значение молярного объёма (то есть объёма, который занимает 1 моль вещества) меняется в широких пределах. Так, молярный объём жидкой воды (плотность 1 г/см3) равен 18 см3, железа (плотность 7,87 г/см3) – 7,1 см3, сахара – 215 см3. В одной столовой ложке помещается 18 г воды, или 1 моль воды.
Моль газообразных веществ имеет разные массы, но также содержит число структурных единиц, равных числу Авогадро.
В правой части таблицы в виде кубиков показана масса 1 моль трёх газов: водорода (2 г), кислорода (32 г) и углекислого газа (44 г).
Газообразное состояние вещества характеризуется бóльшими в сравнении с размерами молекул расстояниями между ними. Доля объёма газа, приходящаяся на собственный объём молекул, составляет около 0,01%, поэтому взаимодействие между ними практически отсутствует. Объём любого газа определяется средним расстоянием между его молекулами, которое зависит от температуры и давления (чем больше молекул содержится в данном объёме газа, тем больше его давление). Поэтому сравнивать объёмы газов можно только при одинаковых условиях – температуре и давлении.
Внизу таблицы представлены массы 1 моль веществ: молекулярного кислорода и угарного газа – оксида углерода(II). Следует обратить внимание на то, что различные по массе газообразные вещества занимают одинаковые объёмы.
Термин "нормальные условия" означает, что газообразное вещество находится при температуре 0 0С и под давлением в 1 атм (или 273,16 К и 101,325 кПа). В качестве параметров состояния вещества иногда выбирают "стандартные условия" (25 0С, 1 атм) или "комнатные (обычные) условия", когда температуру принимают равной 20 или 22 0С.
При нормальных условиях объём, занимаемый 1 моль газа, составляет 22,4 л. Модель молярного объёма газа представляет собой куб с длиной ребра 28,19 см. Нередко возникает вопрос – как вычислен молярный объём. Отношением массы к его плотности (г/л) определяется объёмом тела. В таблице показано, что 1 л О2 имеет массу 1,43 г, а 1 л оксида углерода(II) – 1,25 г. Если условия нормальные, молярные объёмы для всех газов будут одинаковы – 22,4 л.
Легко объясняется и закон Авогадро, если 1 моль газа при нормальных условиях занимает объём 22,4 л, то он содержит 6,02 · 1023 молекул.
Таблица 9
