
- •Начала химии
- •Астрахань
- •1. Химические знаки и атомные массы элементов
- •Химические знаки и атомные массы важнейших элементов
- •2. Распространённость химических элементов
- •Распространённость химических элементов
- •3. Формы существования химических элементов
- •Формы существования химических элементов
- •4. Вещества молекулярного и немолекулярного строения
- •5. Структурные изменения веществ
- •Вещества молекулярного и немолекулярного строения
- •Структурные изменения веществ
- •6. Способы разделения смесей
- •Способы разделения смесей
- •7. Химические знаки и формулы
- •Химические знаки (символы) и формулы
- •8. Составление химических формул по валентности атомов элементов
- •9. Моль – единица количества вещества
- •Составление химических формул по валентности атомов элементов
- •Моль – единица количества вещества
- •10. Физические величины выражения порций вещества
- •Исходные формулы и расчёты на их основе массы, объёма и количества вещества
- •Физические величины выражения порций вещества
- •11. Признаки и условия течения химических реакций
- •Признаки и условия течения химических реакций
- •12. Типы химических реакций
- •Типы химических реакций
- •13. Воздух. Кислород. Горение
- •Воздух. Кислород. Горение
- •14. Строение и характеристика пламени
- •Строение и характеристика пламени
- •15. Составление химических формул солей
- •Составление химических формул солей
- •16. Генетическая связь классов неорганических веществ
- •Генетическая связь классов неорганических веществ
- •Величины и единицы измерения
- •Основные единицы си
- •Приставки для обозначения кратных и дольных единиц от единиц си
- •Важнейшие физические постоянные
- •Обозначения, используемые в химии
- •Оборудование и посуда для химического эксперимента
- •Начала химии
Распространённость химических элементов
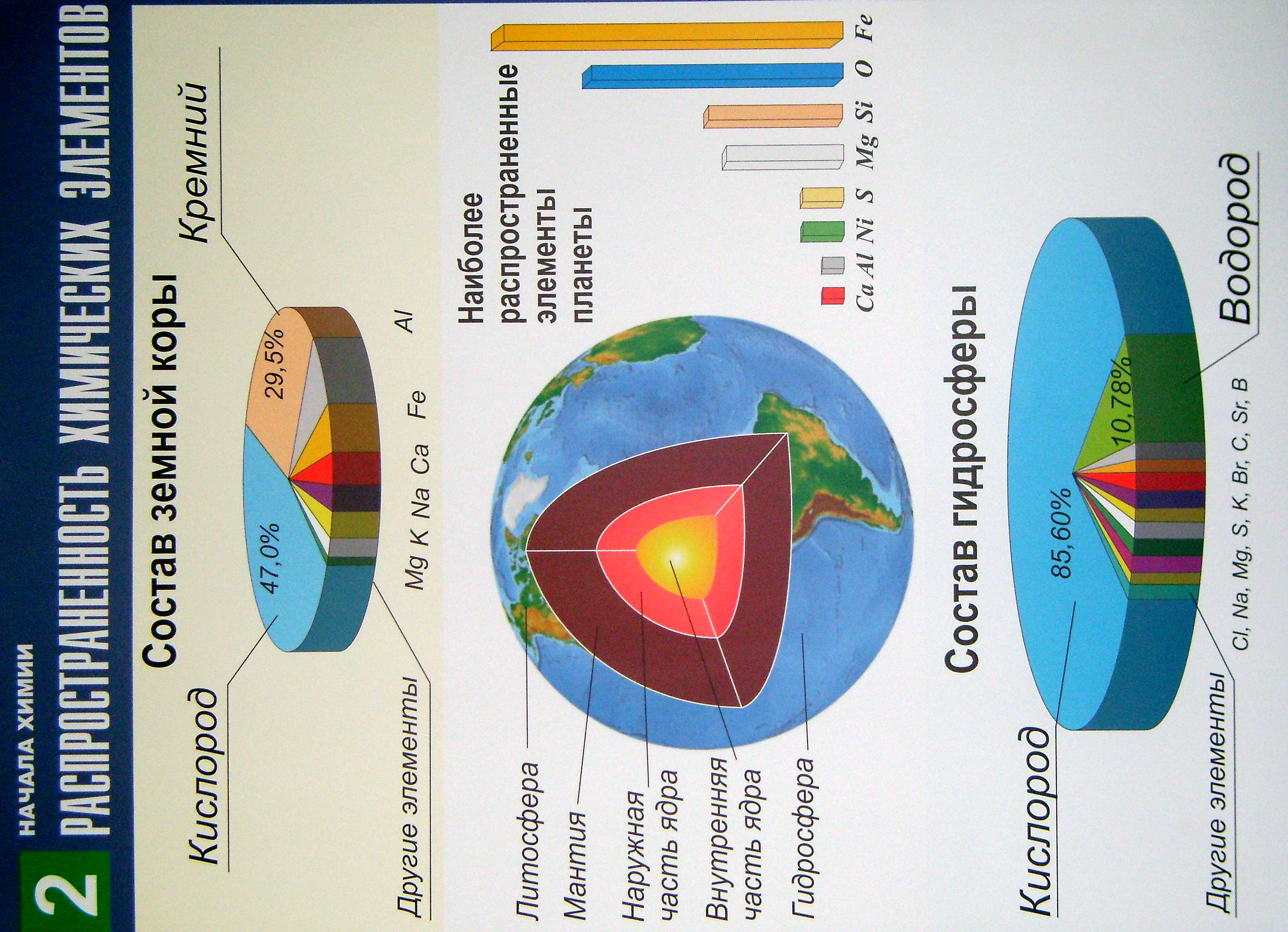
Суммарная доля изображённых на диаграмме восьми наиболее распространённых химических элементов в процентах от массы земной коры составляет 99,03 %. Содержание химических элементов следующее: кислород (47,00 %), кремний (29,50 %), алюминий (8,05 %), железо (4,65 %), кальций (2,96 %), натрий (2,50 %), калий (2,50 %), магний (1,87 %). Содержание всех остальных химических элементов существенно меньше, но именно их разнообразие служит источником богатства земных недр.
Многие химические элементы земной коры встречаются в составе минералов. Земная кора более чем на 99 % состоит из оксидов, среди которых на первом месте оксид кремния(IV) SiО2. При этом доля самого кремнезёма составляет 1/8 массы земной коры, а доля минералов (силикатов, главным образом алюмосиликатов) – 3/4. Намного меньше распространены карбонаты, сульфиды и сульфаты.
Вода – наиболее распространённое химическое соединение на Земле. Мировой океан покрывает более 70 % поверхности Земли. В ледниках и полярных льдах сосредоточено 2 % воды. Количество пресной воды составляет всего 3 %. В состав гидросферы в основном входит 11 химических элементов: кислород (85,60 %), водород (10,78 %), хлор (1,987 %), натрий (1,105 %), магний (0,1326 %), сера (0,0928 %), калий (0,0416 %), бром (0,0068 %), углерод (0,0028 %), стронций (0,0009 %), бор (0,0005 %). Остальные химические элементы в сумме составляют 0,25 %.
Химические элементы на Земле встречаются крайне неравномерно. Многие элементы, расположенные в начале Периодической системы химических элементов Д.И. Менделеева, наиболее распространены в земной коре. Это можно объяснить большой прочностью их ядер атомов. Ядра атомов радиоактивных элементов (расположены в конце Периодической таблице) подвергаются самопроизвольному распаду. Таким образом, распространённость химических элементов связана с зарядом ядер их атомов.
Для полного представления о содержании химических элементов в окружающем мире следует рассмотреть деление элементов по степени их распространённости в атмосфере. Для этого можно использовать таблицу 13 "Воздух. Кислород. Горение". Кроме того, можно рассмотреть распространение химических элементов в космическом пространстве. По мере убывания числа атомов можно составить следующий ряд: Н, Не, О, С, Si, Mg, A1 и т. д. Распространённость водорода и гелия во много раз превосходит остальные химические элементы, в том числе и кислород.
3. Формы существования химических элементов
Таблица 3 помогает обобщить знания об атомах как составных частях всех веществ, понять разницу между понятиями "химический элемент" и "простое вещество", "простое вещество" и "сложное вещество".
Химический элемент – это определённый вид (совокупность) атомов. Условно атомы можно представить в виде шариков различных размеров и цветов. Одиночные атомы в основном существуют в межзвёздном пространстве, где практически отсутствует взаимодействие между ними. В космическом пространстве главным образом находятся атомы водорода Н и гелия Не.
Простые вещества образованы в результате соединения атомов одного химического элемента в молекулы или кристаллы.
Простые вещества–неметаллы в основном состоят из молекул и могут быть газообразными, жидкими или твёрдыми. Благородные (инертные) газы состоят из атомов.
Обычно простые вещества–неметаллы (водород, кислород, сера) принято называть теми же словами, как атомы, а их химические формулы показывают состав молекул.
Химические элементы, образующие простые вещества–металлы, называются металлическими; к ним принадлежит большинство химических элементов. Простые вещества–металлы имеют кристаллическое строение. В случае простых веществ, не состоящих из молекул, символ соответствующего элемента служит химической формулой этого вещества. Поэтому химическими формулами металлов служат символы элементов.
Большинство химических элементов носят те же названия, что и отвечающие им простые вещества.
Сложные вещества состоят не из простых веществ, а из атомов разных химических элементов.
Вещества образуются из атомов за счёт образования между ними химических связей и записываются в виде химических формул.
В качестве примера существования разных форм кислорода можно привести изменение химического состава атмосферы с высотой. В нижних слоях атмосферы присутствует молекулярный кислород – О2, пары воды, а также оксиды серы, углерода и азота. Начиная с высоты 10 км, образуется озон – О3. Выше 40 км в атмосфере увеличивается содержание атомарного кислорода – О, а на высоте 150 км кислород полностью распадается на атомы.
Из таблицы следует вывод: многообразие веществ обусловлено различным сочетанием атомов одного и того же или разных химических элементов друг с другом.
Таблица 3
