
- •Начала химии
- •Астрахань
- •1. Химические знаки и атомные массы элементов
- •Химические знаки и атомные массы важнейших элементов
- •2. Распространённость химических элементов
- •Распространённость химических элементов
- •3. Формы существования химических элементов
- •Формы существования химических элементов
- •4. Вещества молекулярного и немолекулярного строения
- •5. Структурные изменения веществ
- •Вещества молекулярного и немолекулярного строения
- •Структурные изменения веществ
- •6. Способы разделения смесей
- •Способы разделения смесей
- •7. Химические знаки и формулы
- •Химические знаки (символы) и формулы
- •8. Составление химических формул по валентности атомов элементов
- •9. Моль – единица количества вещества
- •Составление химических формул по валентности атомов элементов
- •Моль – единица количества вещества
- •10. Физические величины выражения порций вещества
- •Исходные формулы и расчёты на их основе массы, объёма и количества вещества
- •Физические величины выражения порций вещества
- •11. Признаки и условия течения химических реакций
- •Признаки и условия течения химических реакций
- •12. Типы химических реакций
- •Типы химических реакций
- •13. Воздух. Кислород. Горение
- •Воздух. Кислород. Горение
- •14. Строение и характеристика пламени
- •Строение и характеристика пламени
- •15. Составление химических формул солей
- •Составление химических формул солей
- •16. Генетическая связь классов неорганических веществ
- •Генетическая связь классов неорганических веществ
- •Величины и единицы измерения
- •Основные единицы си
- •Приставки для обозначения кратных и дольных единиц от единиц си
- •Важнейшие физические постоянные
- •Обозначения, используемые в химии
- •Оборудование и посуда для химического эксперимента
- •Начала химии
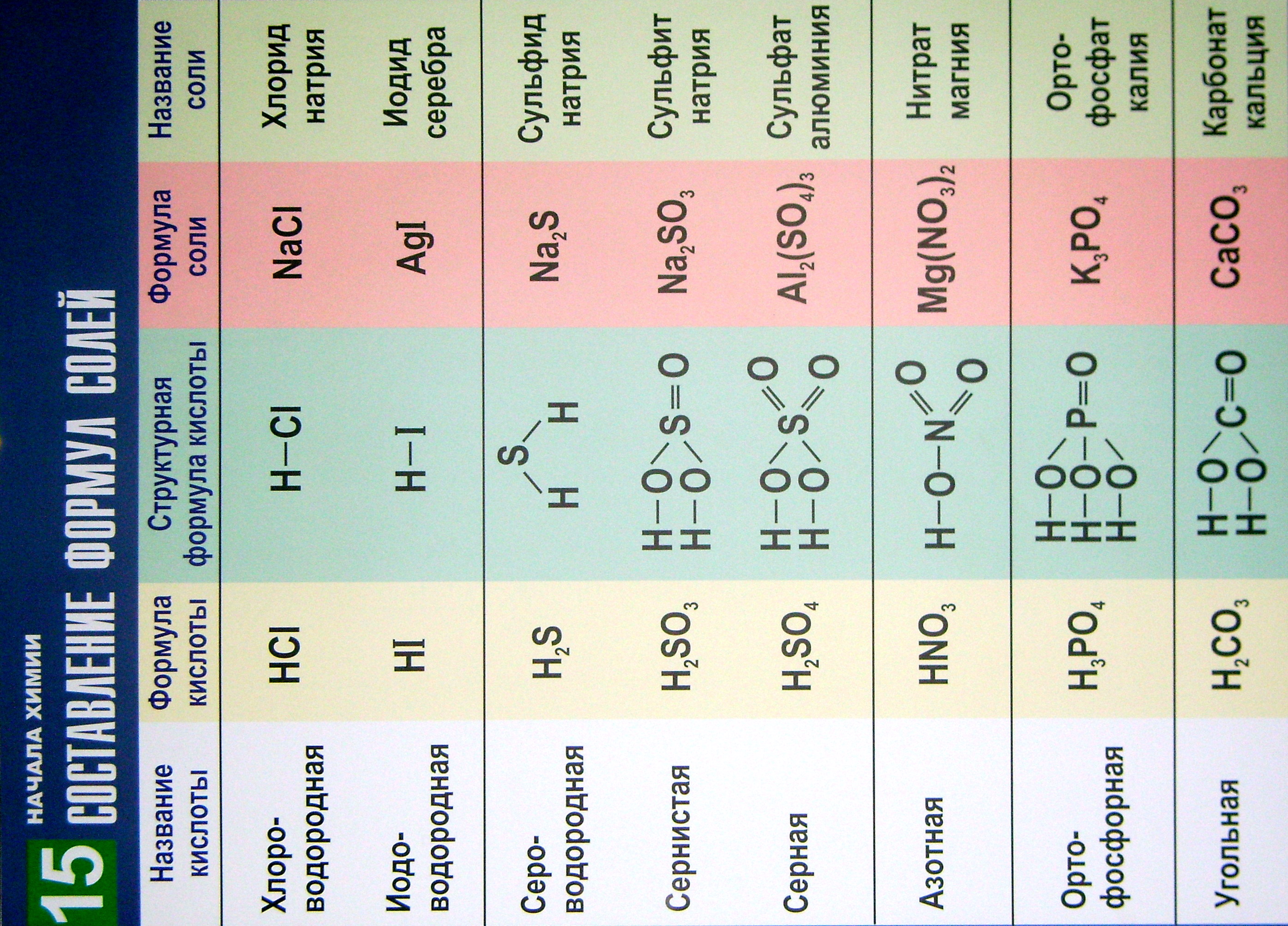
15. Составление химических формул солей
В таблице 15 приведены названия часто встречающихся кислот, их молекулярные и структурные формулы, а также формульные единицы и названия соответствующих солей.
Таблица помогает составлять химические формулы солей бескислородных и кислородсодержащих кислот. Для образования химических формул солей надо атомы водорода в кислотах заменить на атомы металлов с учётом их валентности.
Приведённые названия кислот и солей соответствуют принятой международной номенклатуре.
Название бескислородных кислот образуются по правилам для бинарных соединений.
Названия солей начинаются с названия кислотного остатка в именительном падеже. Это название образуется из корня латинского названия химического элемента, образующего кислоту, и окончания "ат" или "ит" в случае солей кислородсодержащих кислот, для солей бескислородных кислот – "ид". Затем в солях бескислородных кислот называется металл в родительном падеже. Причём если атом металла может иметь разную валентность, то её отмечают римской цифрой (в скобках) после названия химического элемента (без пробела). Например, хлорид железа(II) и хлорид олова(IV).
Включение в таблицу названий молекулярных и структурных формул часто встречающихся кислот позволяет легко запомнить приведённые в ней сведения.
Названия кислот типа HnXOm составляют с учётом валентности (степени окисления) центрального атома:
атом X имеет высшую (или единственную) валентность (степень окисления): H2SО4 – серная; HNО3 – азотная; Н2СО3 – угольная;
атом X имеет промежуточные степени окисления: H2SO3 – сернистая; HNО2 – азотистая; НСlО – хлорноватистая.
Таблица 15
Составление химических формул солей
16. Генетическая связь классов неорганических веществ
Таблица 16 показывает в виде схемы взаимосвязь неорганических веществ разных классов. Изучение свойств веществ показывает, что можно при помощи химических реакций переходить от простых веществ к сложным и от одних сложных веществ к другим. Связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, называется генетической.
Вещества по составу подразделяются на простые и сложные. Среди простых веществ различают металлы и неметаллы. Эти две группы веществ могут образовывать многочисленные сложные вещества. К основным классам неорганических соединений принадлежат оксиды, гидроксиды и соли. Связь между этими классами веществ обозначена при помощи стрелок.
По таблице можно проследить переходы металлов и неметаллов в оксиды и гидроксиды:
металл |
+ |
О2 |
→ |
оксид, |
|
оксид металла |
+ |
Н2О |
→ |
гидроксид1 металла |
|
|
|
|
|
|
|
|
|
|
|
неметалл |
+ |
О2 |
→ |
оксид, |
|
оксид неметалла |
+ |
Н2О |
→ |
кислород содержащая кислота |
Эти две цепочки превращений аналогичны и роднят металлы и неметаллы.
Однако надо подчеркнуть, что простое вещество металл является родоначальником сложных веществ, обладающих оснóвными свойствами (оснóвных оксидов и оснований). Простое вещество неметалл выступает в качестве родоначальника сложных веществ, проявляющих кислотные свойства (кислотных оксидов и кислот).
Различие свойств кислотных и оснóвных оксидов, а также свойств кислот и оснований приводит к их взаимодействию друг с другом с образованием солей. Таким образом, соли генетически связаны с исходными веществами – металлами и неметаллами – посредством их оксидов и гидроксидов.
Так как соли представляют собой продукты реакций кислот и оснований, то по составу различают средние (нормальные), кислые и оснóвные соли. Кислые соли содержат в своём составе атомы водорода, оснóвные – гидроксогруппы. Названия кислых солей складываются из названий солей с прибавлением слова "гидро", а основных – "гидроксо".
Существуют также двойные соли (соли двух металлов), к ним относят, например, алюмокалиевые квасцы KA1(SО4)2 · 12Н2О, смешанные соли NаСl · NаF, СаВrСl, комплексные соли Nа2[Zn(ОН)4], К3[Fе(СN)6], К4[Fе(СN)6], включая кристаллогидраты СuSО4 · 5Н2О (медный купорос), Nа2SО4 · 10Н2О (глауберова соль)
Необходимо научиться составлять химические формулы гидроксидов (кислородсодержащих кислот и оснований) для атома элемента Э с валентностью "n". Гидроксиды получают по реакции присоединения воды к соответствующим оксидам. При этом не имеет значение, происходит ли эта реакция в реальных условиях. Например, химическую формулу угольной кислоты получают сложением всех атомов по уравнению реакции
СО2 + Н2О = Н2СО3.
Химические формулы метафосфорной, пирофосфорной и ортофосфорной кислот составляют из формулы оксида фосфора(V)1 и соответственно одной, двух и трёх молекул воды:
Р2О5 + Н2О = 2НРО3;
Р2О5 + 2Н2О = Н4Р2О7;
Р2О5 + 3Н2О = 2Н3РО4.
Приведённая схема взаимосвязи между классами неорганических веществ не охватывает всего многообразия химических соединений. В этой схеме в качестве бинарных веществ выступают оксиды,
Таблица 16
