
- •Начала химии
- •Астрахань
- •1. Химические знаки и атомные массы элементов
- •Химические знаки и атомные массы важнейших элементов
- •2. Распространённость химических элементов
- •Распространённость химических элементов
- •3. Формы существования химических элементов
- •Формы существования химических элементов
- •4. Вещества молекулярного и немолекулярного строения
- •5. Структурные изменения веществ
- •Вещества молекулярного и немолекулярного строения
- •Структурные изменения веществ
- •6. Способы разделения смесей
- •Способы разделения смесей
- •7. Химические знаки и формулы
- •Химические знаки (символы) и формулы
- •8. Составление химических формул по валентности атомов элементов
- •9. Моль – единица количества вещества
- •Составление химических формул по валентности атомов элементов
- •Моль – единица количества вещества
- •10. Физические величины выражения порций вещества
- •Исходные формулы и расчёты на их основе массы, объёма и количества вещества
- •Физические величины выражения порций вещества
- •11. Признаки и условия течения химических реакций
- •Признаки и условия течения химических реакций
- •12. Типы химических реакций
- •Типы химических реакций
- •13. Воздух. Кислород. Горение
- •Воздух. Кислород. Горение
- •14. Строение и характеристика пламени
- •Строение и характеристика пламени
- •15. Составление химических формул солей
- •Составление химических формул солей
- •16. Генетическая связь классов неорганических веществ
- •Генетическая связь классов неорганических веществ
- •Величины и единицы измерения
- •Основные единицы си
- •Приставки для обозначения кратных и дольных единиц от единиц си
- •Важнейшие физические постоянные
- •Обозначения, используемые в химии
- •Оборудование и посуда для химического эксперимента
- •Начала химии
Типы химических реакций

13. Воздух. Кислород. Горение
Кислород является самым распространённым химическим элементом на Земле. Содержание его в земной коре и гидросфере представлено в таблице 2 "Распространённость химических элементов". На долю кислорода приходится примерно половина (47 %) массы литосферы. Он является преобладающим химическим элементом гидросферы. В земной коре кислород присутствует только в связанном виде (оксиды, соли). Гидросфера также представлена в основном связанным кислородом (часть молекулярного кислорода растворена в воде).
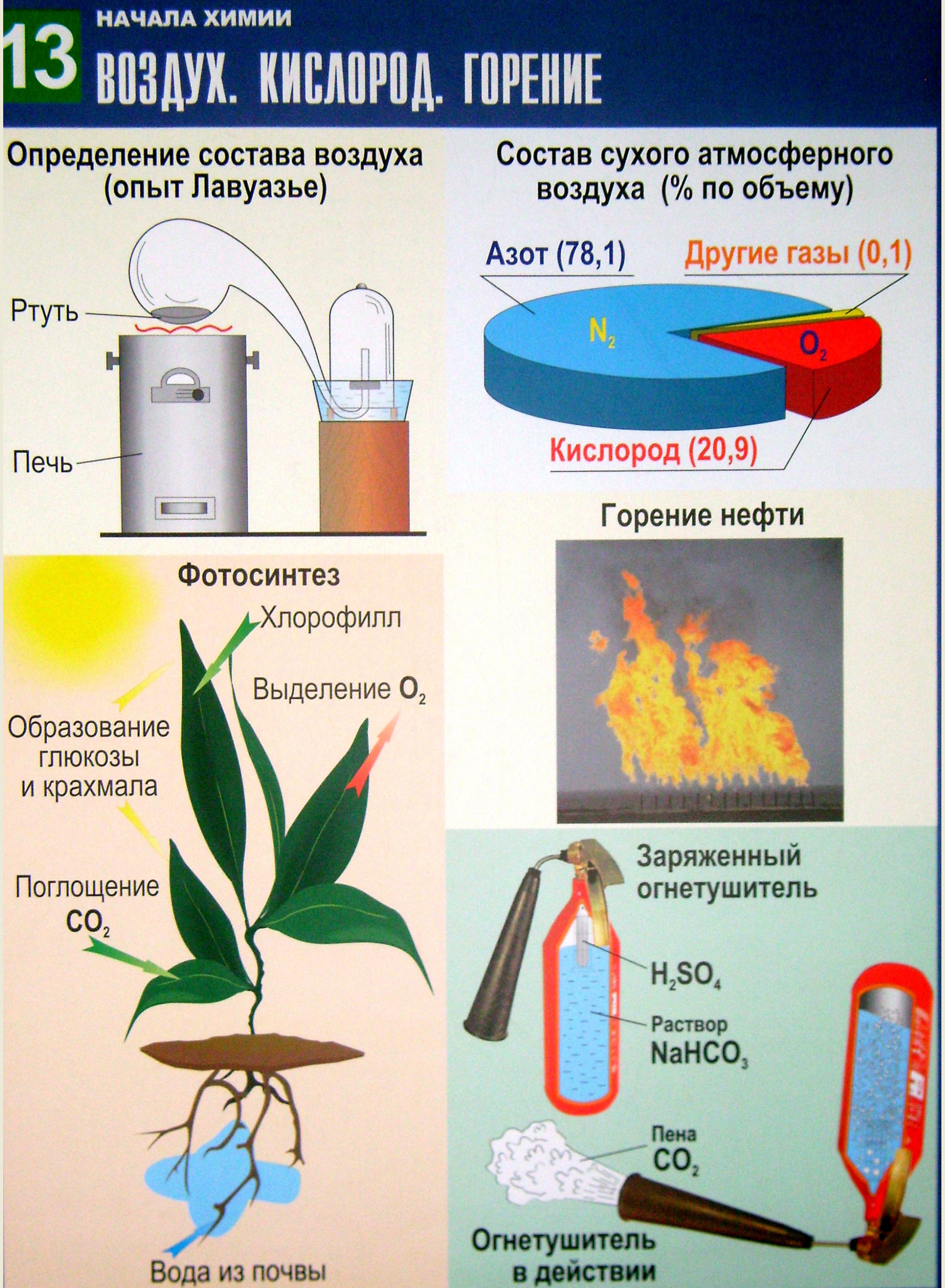
В атмосфере свободного кислорода содержится 20,9 % по объёму. Воздух – сложная смесь газов. Сухой воздух на 99,9 % состоит из азота (78,1 %), кислорода (20,9 %) и аргона (0,9 %). Содержание этих газов в воздухе практически постоянно. В состав сухого атмосферного воздуха также входят диоксид углерода, неон, гелий, метан, криптон, водород, оксид азота(I) (оксид диазота, гемиоксид азота – N2О), озон, диоксид серы, монооксид углерода, ксенон, оксид азота(IV) (диоксид азота – NО2).
Состав воздуха определил французский химик Антуан Лоран Лавуазье в конце XVIII века (таблица 13). Он доказал содержание кислорода в воздухе, и назвал его "жизненный воздух". Для этого он нагревал на печи ртуть в стеклянной реторте, тонкая часть которой поводилась под стеклянный колпак, опущенный в водяную баню. Воздух под колпаком оказывался замкнутым. При нагревании ртуть соединялась с кислородом, превращаясь в оксид ртути красного цвета. "Воздух", оставшийся в стеклянном колпаке после нагревания ртути, не содержал кислорода. Мышь, помещённая под колпак, задыхалась. Прокалив оксид ртути, Лавуазье снова выделил из него кислород и вновь получил чистую ртуть.
Содержание кислорода в атмосфере стало заметно увеличиваться около 2 млрд. лет назад. В результате реакции фотосинтеза поглощался некоторый объём углекислого газа и выделялся такой же объём кислорода. На рисунке таблицы схематически показано образование кислорода при фотосинтезе. В процессе фотосинтеза в листьях зелёных растений, содержащих хлорофилл, при поглощении солнечной энергии происходит превращение воды и углекислого газа в углеводы (сахара) и кислород. Реакцию образования глюкозы и кислорода в зелёных растениях можно записать в следующем виде:
6Н2О + 6СО2 = С6Н12О6 + 6О2↑.
Образующаяся глюкоза превращается в нерастворимый в воде крахмал, который накапливается в растениях.
Таблица 13
Воздух. Кислород. Горение
Фотосинтез представляет собой сложный химический процесс, включающий несколько стадий: поглощение и транспортировку солнечной энергии, использование энергии солнечного света для инициирования фотохимических окислительно-восстановительных реакций, восстановление углекислого газа и образованием углеводов.
Солнечный свет – это электромагнитное излучение разных длин волн. В молекуле хлорофилла при поглощении видимого света (красного и фиолетового) происходят переходы электронов из одного энергетического состояния в другое. На фотосинтез расходуется только небольшая часть солнечной энергии (0,03 %), достигающей поверхности Земли.
Весь имеющийся на Земле диоксид углерода проходит через цикл фотосинтеза в среднем за 300 лет, кислород – за 2000 лет, вода океанов – за 2 млн. лет. В настоящее время в атмосфере установилось постоянное содержание кислорода. Он практически полностью расходуется на дыхание, горение и гниение органических веществ.
Кислород – одно из самых активных веществ. Процессы с участием кислорода называются реакциями окисления. К ним относят горение, дыхание, гниение и многие другие. На таблице показано горение нефти, которое идёт с выделением теплоты и света.
Реакции горения могут принести не только пользу, но и вред. Горение можно остановить, прекратив доступ воздуха (окислителя) к горящему предмету с помощью пены, песка или одеяла.
Пенные огнетушители наполняют концентрированным раствором питьевой соды. При её контакте с концентрированной серной кислотой, находящейся в стеклянной ампуле в верхней части огнетушителя, образуется пена углекислого газа. Для приведения в действие огнетушитель переворачивают и ударяют об пол металлическим штифтом. При этом ампула с серной кислотой разбивается и образующийся в результате реакции кислоты с гидрокарбонатом натрия углекислый газ вспенивает жидкость и выбрасывает её из огнетушителя сильной струёй. Пенистая жидкость и углекислый газ, обволакивая горящий предмет, оттесняют воздух и гасят пламя.
