
- •Модели в механике. Система отсчета. Траектория, длина пути, вектор перемещения. Мгновенная скорость, мгновенное ускорение.
- •Криволинейное движение материальной точки. Вывод формул тангенциального и нормального ускорений. Простейшие виды движения материальной точки.
- •Вращательное движение. Угол поворота. Угловая скорость. Угловое ускорение. Связь между угловыми и линейными характеристиками движения.
- •Динамика материальной точки. Масса. Сила. Законы Ньютона. Инерциальные системы отсчета. Импульс силы.
- •Механическая система. Внутренние и внешние силы. Центр масс.
- •Понятие энергии и работы. Работа переменной силы. Консервативные и диссипативные силы. Мощность.
- •7. Потенциальная энергия. Потенциальные поля. Потенциальная энергия гравитационного взаимодействия и упругой деформации.
- •Работа упругой силы (потенциальная энергия упруго деформированного тела)
- •8. Кинетическая энергия. Полная механическая энергия системы.
- •Вращательное движение твердого тела. Динамические .Характеристики {момент силы, момент инерции). Теорема Штейнера.
- •1.Момент силы, действующей на материальную точку, относительно оси вращения.
- •2. Момент импульса.
- •3. Момент инерции материальной точки относительно оси вращения
- •4.Теорема Штейнера.
- •Кинетическая энергия вращающегося тела. Основное уравнение динамики вращательного движения.
- •Основные величины поступательного движения и их аналоги во вращательном движении. Аналоги трех законов Ньютона для вращательного движения твердого тела
- •Закон всемирного тяготения. Сила тяжести. Вес. Невесомость.
- •Поле тяготения. Напряженность и потенциал поля.
- •Неинерциальные системы отсчета. Силы инерции при ускоренном поступательном движении системы отсчета. Примеры
- •Неинерциальные системы отсчета. Силы инерции, действующие из тело, покоящееся во вращающейся системе отсчета.
- •Неинерциальные системы отсчета. Силы инерции, действующие на тело, движущееся во вращающейся системе отсчета.
- •Уравнение движения тела переменной массы.
- •Силы трения. Виды трения. Коэффициент трения.
- •Деформация твердого тела. Деформация растяжения (сжатия). Закон Гука. Деформация сдвига.
- •Закон сохранения импульса. Абсолютно неупругий удар.
- •21. Закон сохранения механической энергии. Абсолютно упругий удар.
- •22. Момент импульса твердого тела. Закон сохранения момента импульса.
- •Преобразования Галилея. Принцип относительности в классической механике.
- •Специальная теория относительности. Постулаты Эйнштейна. Преобразования Лоренца.
- •Вид преобразований при коллинеарных (параллельных) пространственных осях
- •Важнейшие следствия из преобразований Лоренца: одновременность событий, длительность событий, длина тел в различных системах отсчета.
- •Специальная теория относительности. Закон взаимодействия массы и энергии.
- •Гармонические колебательные движения. Свободные колебания. Дифференциальное уравнение свободных незатухающих колебаний.
- •1.1. Свободные незатухающие колебания пружинного маятника
- •Пружинный, физический, математический маятники. Маятник Максвелла.
- •Дифференциальное уравнение свободных затухающих колебаний и его решение. Декремент затухания, логарифмический декремент затухания, добротность контура.
- •30. Дифференциальное уравнение вынужденных колебаний и его решение. Явление механического резонанса. Резонансные кривые.
- •31. Волновые процессы. Уравнение бегущей волны. Фазовая скорость. Понятие дисперсии. Волновое уравнение. Стоячие волны.
- •32. Звуковые волны. Эффект Доплера в акустике.
- •33. Статистический и термодинамический методы исследования. Параметры состояния системы. Равновесные состояния. Равновесные процессы.
- •Основное уравнение молекулярно-кинетической теории идеальных газов. Связь между температурой и средней кинетической энергией поступательного движения молекулы газа.
- •Распределение по проекции скорости
- •Распределение по модулю скоростей
- •Внутренняя энергия идеального газа. Понятие числа степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы.
- •Понятие эффективного диаметра молекулы. Среднее число столкновений одной молекулы в единицу времени. Средняя длина свободного пробега молекулы и ее зависимость от давления и температуры.
- •Первый закон термодинамики. Внутренняя энергия системы. Работа, совершаемая газом.
- •Применение первого закона термодинамики к изобарическому и изотермическому процессам.
- •41. Применение первого закона термодинамики к изохорическому и адиабатическому процессам.
- •42. Теплоемкость (удельная, молярная). Уравнение Майера. Связь теплоемкости с числом степеней свободы молекулы.
- •43. Политропические процессы в идеальном газе. Уравнение политропы. Изопроцессы, как частные случаи политропического процесса. Теплоемкость при политропическом процессе.
- •Круговые процессы (циклы). Обратимые и необратимые процессы. Примеры. Тепловая машина и ее кпд. Цикл Карно и его кпд. . .
- •Второй закон термодинамики и его различные формулировки.
- •Энтропия. Основные свойства энтропии (формулировка второго закона термодинамики). Статистический смысл энтропии. Формула Больпмана.
- •47. Явления переноса. Теплопроводность, диффузия, внутреннее трение в газах. Уравнения, описывающие эти явления. Коэффициенты переноса.
- •Реальные газы. Силы межмолекулярного взаимодействия
- •Реальные газы. Уравнение Ван-дер-Ваальса. Смысл поправок в уравнении.
- •Изотермы реального газа. Критические параметры реального газа. Экспериментальные изотермы реального газа.
- •Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
- •Фазовые превращения "твердых тел. Плавление и кристаллизация.
- •Вязкость (внутреннее трение). Методы определения вязкости.
42. Теплоемкость (удельная, молярная). Уравнение Майера. Связь теплоемкости с числом степеней свободы молекулы.
УРАВНЕНИЕ МАЙЕРА
- ур-ние, устанавливающее связь между
теплоёмкостями при пост, давлении Cp
и пост, объёме СV 1 кмоля
идеального газа:![]() где R - газовая
постоянная . Для произвольной
массы т (кг) вещества в состоянии
идеального
газа уравнение Майера записывается
в виде:
где R - газовая
постоянная . Для произвольной
массы т (кг) вещества в состоянии
идеального
газа уравнение Майера записывается
в виде:
![]() ,
где
,
где
![]() -
молекулярная масса газа. M. у. можно
получить из общего соотношения
-
молекулярная масса газа. M. у. можно
получить из общего соотношения
![]() ,если
учесть, что для идеального газа справедливо
Клапейрона
уравнение.
,если
учесть, что для идеального газа справедливо
Клапейрона
уравнение.
Каждое независимое движение называется
степенью свободы. Таким образом,
одноатомная молекула имеет 3 поступательные
степени свободы, «жесткая» двухатомная
молекула имеет 5 степеней (3 поступательные
и 2 вращательные), а многоатомная молекула
– 6 степеней свободы (3 поступательные
и 3 вращательные). В классической
статистической физике доказывается
так называемая теорема о равномерном
распределении энергии по степеням
свободы: Если система молекул находится
в тепловом равновесии при температуре
T, то средняя кинетическая энергия
равномерно распределена между всеми
степенями свободы и для каждой степени
свободы молекулы она равна
 Из
этой теоремы следует, что молярные
теплоемкости газа Cp и CV и их отношение
γ могут быть записаны в виде
Из
этой теоремы следует, что молярные
теплоемкости газа Cp и CV и их отношение
γ могут быть записаны в виде
|
где i – число степеней свободы газа. Для газа, состоящего из одноатомных молекул (i = 3)
|
Для газа, состоящего из двухатомных молекул (i = 5)
|
Для газа, состоящего из многоатомных молекул (i = 6)
|
Теплоёмкость
тела (обозначается C) — физическая
величина, определяющая отношение
бесконечно малого количества
теплоты ΔQ, полученного телом,
к соответствующему приращению его
температуры
ΔT:
![]() Единица измерения теплоёмкости в системе
СИ
— Дж/К.
Удельная теплоемкость вещества —
величина, равная количеству теплоты,
необходимому для нагревания 1 кг
вещества на 1 К:
Единица измерения теплоёмкости в системе
СИ
— Дж/К.
Удельная теплоемкость вещества —
величина, равная количеству теплоты,
необходимому для нагревания 1 кг
вещества на 1 К:
 Единица удельной теплоемкости — джоуль
на килограмм-кельвин (Дж/(кг × К)). Молярная
теплоемкость—величина, равная количеству
теплоты, необходимому для нагревания
1 моль вещества на 1 К:
Единица удельной теплоемкости — джоуль
на килограмм-кельвин (Дж/(кг × К)). Молярная
теплоемкость—величина, равная количеству
теплоты, необходимому для нагревания
1 моль вещества на 1 К:
 где n=m/М—количество
вещества. Единица молярной теплоемкости
— джоуль на моль-кельвин (Дж/(моль × К)).
Удельная теплоемкость с связана с
молярной Сm,
соотношением
где n=m/М—количество
вещества. Единица молярной теплоемкости
— джоуль на моль-кельвин (Дж/(моль × К)).
Удельная теплоемкость с связана с
молярной Сm,
соотношением ![]() где
М — молярная масса вещества. Различают
теплоемкости при постоянном объеме и
постоянном давлении, если в процессе
нагревания вещества его объем или
давление поддерживается постоянным.
где
М — молярная масса вещества. Различают
теплоемкости при постоянном объеме и
постоянном давлении, если в процессе
нагревания вещества его объем или
давление поддерживается постоянным.
43. Политропические процессы в идеальном газе. Уравнение политропы. Изопроцессы, как частные случаи политропического процесса. Теплоемкость при политропическом процессе.
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В
соответствии с сущностью понятия
теплоёмкости
,
предельными частными явлениями
политропного процесса являются
изотермический
процесс
(![]() )
и адиабатный
процесс
(
)
и адиабатный
процесс
(![]() ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными ?.
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:
![]()
где р — давление, V — объем газа, n — «показатель политропы».
 .
Здесь
—
теплоёмкость газа в данном процессе,
.
Здесь
—
теплоёмкость газа в данном процессе,
![]() и
и
![]() —
теплоемкости того же газа, соответственно,
при постоянном давлении и объеме.
—
теплоемкости того же газа, соответственно,
при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
Изотермический процесс:
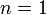 ,
так как
,
так как
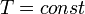 ,
значит, по закону
Бойля — Мариотта
,
значит, по закону
Бойля — Мариотта
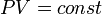 ,
и уравнение политропы вынуждено
выглядеть так:
,
и уравнение политропы вынуждено
выглядеть так:
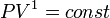 .
.
Изобарный процесс:
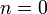 ,
так как
,
так как
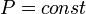 ,
и уравнение политропы вынуждено
выглядеть так:
,
и уравнение политропы вынуждено
выглядеть так:
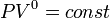 .
.
Адиабатный процесс:
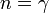 (здесь
(здесь
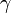 —
показатель
адиабаты),
это следует из уравнения
Пуассона.
—
показатель
адиабаты),
это следует из уравнения
Пуассона.
Изохорный процесс:
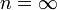 ,
так как
,
так как
 ,
и в процессе
,
и в процессе
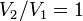 ,
а из уравнения политропы следует, что
,
а из уравнения политропы следует, что
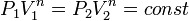 ,
то есть, что
,
то есть, что
 ,
то есть
,
то есть
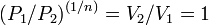 ,
а это возможно, только если
,
а это возможно, только если
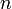 является
бесконечным.
является
бесконечным.

