
- •Часть 1
- •Тема 1. Основные и технологические понятия и определения.
- •§ 1. Классификация моделей хтс.
- •1) Функциональная (принципиальная)
- •1) Основные операторы:
- •Вспомогательные операторы:
- •§ 2. Типы технологических связей хтп.
- •1) Последовательная; 2) Параллельная; 3) Обводная (байпас); 4) Рециркуляционная;
- •§ 3 Классификация химических реакций применяемых в промышленности.
- •1) Гомо и гетерофазные процессы.
- •2) Гомо и гетерогенные процессы.
- •3) Простые и сложные реакции.
- •4) Элементарные и неэлементарные реакции.
- •§ 4 Безразмерные характеристики материального баланса.
- •§ 5 Материальный баланс и его характеристики (простые реакции).
- •§ 6 Тепловой баланс и хтп и его характеристика.
- •Тема 2. Прикладная термодинамика химических процессов.
- •§ 1. Расчет тепловых эффектов химических реакций.
- •§ 2. Термодинамическая вероятность протекания химических реакций.
- •§ 3. Расчет равновесия обратимых химических реакций.
- •Закон действующих масс.
- •§ 4. Экспериментальное определение равновесного состава реакционной массы и константы равновесия.
- •§ 6. Законы смешения равновесия.
- •I) Давление.
- •II) Концентрация веществ.
- •III) Температура.
- •Тема 3: Кинетика гомогенных химических процессов.
- •§ 1 Скорость химических процессов.
- •Зависимость скорости химической реакции от концентрации исходных веществ. Основной закон кинетики.
- •1) Метод.
- •2) Метод
- •Зависимость скорости химической реакции от температуры. Общее кинетическое уравнение.
- •§2 Исследование кинетики гомогенных химических реакций.
- •Исследование гомогенных химических реакций в реакторах периодического действия емкостного типа.
- •Интегральный метод анализа кинетической зависимости.
- •Тема 4: Особенности кинетики гетерогенных каталитических процессов (гкп).
- •§1 Основные стадии гкп. Общее уравнение кинетики.
- •1) Внешнедиффузионная.
- •2) Внутренняя диффузия.
- •4) Химическое превращение.
- •§2 Внешнедиффузионная и внутредиффузионная области, лимитирующие в гетерогенном каталитическом процессе.
- •§3 Адсорбция на поверхности катализатора.
- •Основные положения теории:
- •§5. Кинетика реакции на поверхности катализаторов (кинетическая область, как лимитирующая гкп).
- •§6 Исследование кинетики гкп.
- •§7 Определение лимитирующей стадии гкп.
- •Часть 2 Основы расчета химических реакторов. Классификация химических реакторов.
- •Тема 1. Расчет изотермических реакторов для проведения гомогенных реакций..
- •§ 1. Реактор рис-п.
- •§ 2. Реактор идеального смешения рис-н.
- •§ 3. Реактор идеального вытеснения рис-в.
§ 4. Экспериментальное определение равновесного состава реакционной массы и константы равновесия.
Когда точные данные по термодинамическим
функциям в литературе отсутствуют, для
количественного расчета константы
равновесия необходимо экспериментально
изучать равновесие обратимых химических
реакций. Методы экспериментального
определения константы равновесия
основаны на анализе состава реакционной
массы после достижения состояния
равновесия. Для получения надежных
результатов кроме обычной проверки на
воспроизводимость необходимо ставить
эксперименты таким образом, чтобы
состояние равновесия достигалось с
разных сторон, то есть при первоначальном
протекании, как прямой, так и обратной
реакции.
![]() .
Только совпадение в пределах ошибки
опыта аналитических данных по составу
реакционной массы может гарантировать,
что изучается истинное равновесие.
Основные экспериментальные методы для
определения константы равновесия
делятся на 2-е группы: 1) Статические; 2)
Динамические.
.
Только совпадение в пределах ошибки
опыта аналитических данных по составу
реакционной массы может гарантировать,
что изучается истинное равновесие.
Основные экспериментальные методы для
определения константы равновесия
делятся на 2-е группы: 1) Статические; 2)
Динамические.
1) При статическом методе используются периодически действующие реакторы и ведут ся химические процессы в них до тех пор, пока результаты анализа реакционной массы не окажутся практически одинаковыми.

2) Динамический метод основан на
использовании реакторов вытеснения,
которые особенно удобны для изучения
равновесия газофазных гетерогенных
каталических процессов.
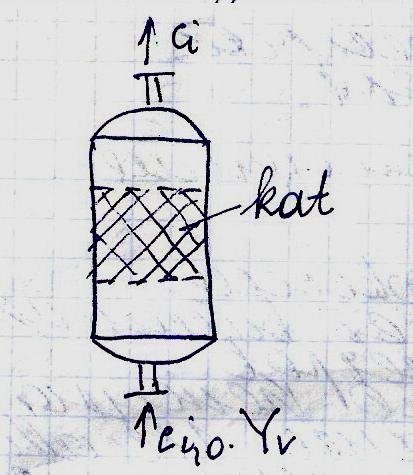 В этом случае постепенно увеличивают
условное время пребывания реакционной
массы в реакторе, пока на выходе не будет
достигнут практически постоянный
состав.
В этом случае постепенно увеличивают
условное время пребывания реакционной
массы в реакторе, пока на выходе не будет
достигнут практически постоянный
состав.
 после определения этими методами
равновесных значений концентрации
расчет констант равновесия выполняют
по уравнению 11. эти результаты достаточны
для определения состава равновесных
смесей при любом соотношении исходных
реагентов в случае идеальных систем.
после определения этими методами
равновесных значений концентрации
расчет констант равновесия выполняют
по уравнению 11. эти результаты достаточны
для определения состава равновесных
смесей при любом соотношении исходных
реагентов в случае идеальных систем.
§ 6. Законы смешения равновесия.
Положение равновесия всегда зависит от внешних условий параметров технологического режима, а так как внешнее условие долго не могут сохраняться неизменными, то равновесие рано или поздно нарушается. Влияние изменение внешних условий на положение равновесия – принцип смещения равновесия, называемый принцип Ле Шателье можно сформулировать следующим образом: если на систему, находящуюся в устойчивом равновесии, воздействовать из вне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится направление реакции, течение которой ослабляет внешнее произведенное воздействие. И положение равновесия смещается в том же направлении. Наиболее существенное влияние на состояние равновесия обратимых реакций, оказывает давление, концентрация вещества и температура.
I) Давление.
Характер влияния давления на равновесия
химической реакции определяется законом
изменения объема или изменения числа
молей газообразных реагентов:
![]()
1) Для газофазных реакций, в которых
число молей продуктов превышает число
молей реагентов, то есть Δn>0,
увеличение давления в системе не
благополучно сказывается на выходе
продукта. При повышении P,
равновесие смещается в сторону реагентов![]() .
Для повышения выхода целевого продукта,
такие реакции следует проводить при
пониженном давлении. При понижении P,
равновесие смещается в сторону продуктов
.
Для повышения выхода целевого продукта,
такие реакции следует проводить при
пониженном давлении. При понижении P,
равновесие смещается в сторону продуктов
![]() .
.
2) Если же реакция протекает с уменьшением числа молей, то повышение давления смещает равновесие в сторону образования целевых продуктов: Δn<0. Тогда при повышении давления, в сторону продуктов . При понижении давления, в сторону реагентов . Чувствительность положения равновесия к изменению давления тем больше, чем больше изменение объема сопровождает тот или иной процесс.
3) Δn=0, то изменение давления не оказывает никакого влияния на состояние равновесия.
