
- •Раздел 7. Концепция атомизма и строение материи
- •7.1 Понятие материи
- •7.2 Вещество и поле. Структурные уровни организации материи
- •7.3 Элементарные частицы и их классификация
- •7.4 Атомные ядра
- •7.5 Ядерные реакции. Радиоактивность.
- •7.6 Учение о строении атома
- •7.7 Атомы
- •7.8 Молекулы
- •7.9 Виды веществ и их агрегатное состояние
7.8 Молекулы
Молекула есть наименьшая структурная единица химического состояния.
Молекулы состоят из атомов одинаковых или различных химических элементов. Силы, удерживающие атомы в молекулах, являются проявлением электромагнитного взаимодействия.
Существует два типа связей атомов в молекулах: ионная и ковалентная.
Ионная связь заключается в том, что валентные электроны у атомов ряда элементов слабо связанны с атомом в целом, легко теряются атомом. В этом случае атом превращается в положительно заряженный ион.
Атомы других элементов, напротив, могут захватывать “чужие” электроны, образуя отрицательно заряженный ион.
Между разноименно заряженными ионами действуют кулоновские силы притяжения, которые обеспечивают образование и устойчивость молекул. Например, в молекуле хлористого натрия NaClатом натрия Na на подуровне 3s один электрон, слабо связанный с атомом в целом. Атом же хлора Clимеет почти заполненный уровень (не хватает одного электрона). Этот недостающий электрон захватывается атомом хлора у атома натрия, в результате чего образуется два иона: Na+и Cl- . За счет ионной связи образуются молекулы – пары “щелочной металл – галоген”, “щелочноземельный металл – оксиген” и др.
Ионная связь характеризуется полным обменом зарядами между ионами, за счет объединения внешних электронных оболочек. Общая молекулярная оболочка подобна оболочке инертных газов. Это довольно сильная связь: например, для молекулы NaClэнергия связи, приходящаяся на одну молекулу, равна 7,9эВ.
Ковалентная связь – это связь атомов посредством общих электронных пар. Она возникает, например, при образовании молекул из одинаковых атомов (Н2, О2, N2 и др.). В этом случае выделить положительные и отрицательные ионы невозможно.
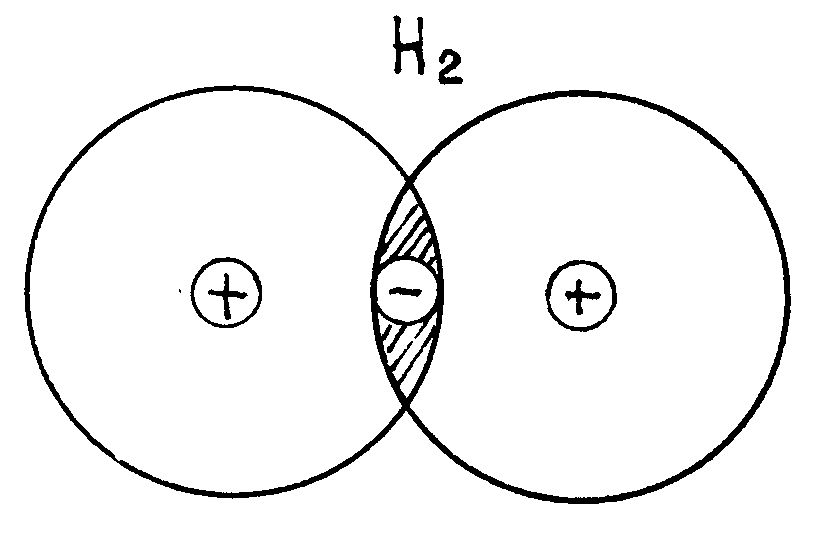
Рис. 7.8. Образование ковалентной связи
Как показано на рис.7.8. в промежутке между положительно заряженными ядрами возникает область отрицательного пространственного заряда, обусловленного наличием “общих” электронов.
Сила кулоновского притяжения, действующая со стороны отрицательно заряженного ядра на положительный, больше, чем сила отталкивания последних, что обеспечивает существование молекул данного типа. При этом происходит лишь частичный обмен зарядами. В каждой ковалентной связи участвуют только два электрона – по одному от каждого атома. Эти электроны наиболее вероятно находятся в области перекрытия их волновых функций.
Ковалентная связь направленная и обладает свойством насыщения, т.е. у атома может быть столько ковалентных связей, сколько у него валентных электронов.

Рис. 7.9. Ковалентная связь атома углерода
Например, четырехвалентный атом углерода С может вступать в ковалентную связь только с четырьмя такими же атомами (рис.7.9)
Свойства молекулы определяются не только ее составом, т.е. видом входящих в нее атомов, но и пространственной структурой. Между молекулами (а также атомами и ионами) действуют силы, величина которых зависит от агрегатного состояния вещества. В случае твердых тел и жидкостей эти силы задают объем тела. Он может изменяться (уменьшаться или увеличиваться) только под воздействием внешней силы. Это означает, что молекулы располагаются на некотором расстоянии друг от друга (rp- равновесное расстояние) .
Если расстояние между молекулами оказывается меньше равновесного (r < rp), между молекулами возникают силы отталкивания, при r > rp– силы притяжения.
 Рис.7.10.
Межмолекулярные силы
Рис.7.10.
Межмолекулярные силы
Силы межмолекулярного взаимодействия представляют собой равнодействующую сил отталкивания и притяжения, компенсирующих друг друга при равновесном состоянии между молекулами.
Из большого числа исходных молекул (мономеров) могут образовываться большие и прочные макромолекулы.
Макромолекулы одного и того же вида отличаются друг от друга размерами, формой, некоторыми другими признаками и объединяются в общий класс исходных полимеров. Примером могут служить органические вещества - углеводороды.
Простейшее углеводородное соединение – метан. Молекула его имеет следующую структуру:
Н
¦
Н — С — Н или СН4
¦
Н
В соответствии с общей формулой предельных углеводородов CnH2n+2 можно получить и другие углеводородные соединения, такие как: этан – C2H6(CH3 – CH3) пропан – C3H8(CH3 – CH2– CH3) и др.
Для непредельных углеводородов (в молекулах которых между атомами углерода имеются двойные или тройные связи) общая формула может иметь вид CnH2n-2. Например, молекула ацетилена H – C ? C – H.
По иному обстоит дело при синтезе макромолекул в живых организмах (биосинтез). В этом случае образуются абсолютно идентичные макромолекулы (например, белки), что обеспечивает устойчивость в воспроизводстве себе подобных живых организмов. Программа построения молекул заложена в молекулах – матрицах, несущих информацию о наследственности (типа дезоксирибонуклеиновой кислоты –ДНК).
