
- •Материя, вещество, поле. Предмет изучения химии.
- •С троение атома.
- •П отенциал ионизации, атомный радиус, относительная электроотрицательность элементов.
- •6 . Химическая связь.
- •8. Взаимодействие между молекулами: водородная связь (ионная и ковалентная составляющие); межмолекулярное взаимодействие за счет сил Ван-Дер-Ваальса (ориентационное, индукционное, дисперсионное).
- •10)А)Химическая термодинамика, термодинамические параметры. Первый закон термодинамики.
- •12) 12) Энтропия как мера беспорядка в системе . Термодиномическая вероятность состояния системы(w).
- •13) Химическая кинетика. Понятие о скорости химической реакции.
- •20.Понятие об идеальных растворах. Закон Рауля. Осмос. Физический смысл эбулиоскопической и криоскопической константы.
- •22. Произведение растворимости труднорастворимых в воде веществ, являющихся сильными электролитами (вывод правила, определение, применение на практике).
- •23. Ионное произведение воды (вывод правила, определение, применение на практике). Вывод понятия о рН растворов.
- •1. Взаимодействие металлов с простыми веществами:
- •2.Взаимодействие металлов со сложными веществами:
- •36. Взаимодействие металлов с разбавленной и концентрированной серной кислотой.
- •37. Взаимодействие с разбавленной и концентрированной азотной кислотой
- •38. Кислоты
- •39. Коррозия
- •40. Газовая коррозия
- •41. Электрохимическая коррозия
- •42.Cпособы защиты от коррозии,использование благородных металлов,сплавов,введение в поверхность металлических деталей дополнительных элементов.
- •44.Применение ингибиторов.Примеры ингибиторов,механизм их действия.
- •43.Электрохимическая защита ,протекторная иэлектрозащита(привести схемы ,реакции на аноде,катоде,дать сравнительную характеристику)
- •45.Защитные покрытия.Классификация.Методы нанесения защитных покрытий.
- •46.Полимеры.Определение.Строение макромолекул.Степень(коэффициент) полимеризации.Олигомеры,полимеры-сравнительная характеристика.
- •53) Термодинамическая совместимость армирующей фазы и матрицы. Понятие о химическом потенциале.
- •54) Типы связей между армирующей фазой и матрицей.
- •55) Операции при подготовке армирующей фазы и матрицы и При получении композита.
- •56) Шликерное формование композита (матрица - Cu, армирующая фаза – Al2o3), реакции на аноде и катоде, расчет % состава композита ( лаб. Работа).
6 . Химическая связь.
Объяснение механизма образования связи в молекуле Н2 (модель Гейтлера-Лондона).
Метод валентных связей впервые был использован в 1927 г. Немецкими учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет молекулы водорода. Гейтлер и Лондон показали, что при сближении двух атомов водорода с антипараллельными спинами происходит уменьшение энергии системы (кривая 1), что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. Рассчитанная ими энергия связи отличалась от экспериментальной не более чем на 10%. При сближении атомов с параллельными спинами энергия системы возрастает (кривая 2), и молекула в этом случае не образуется. Позднее метод ВС получил дальнейшее развитие и был распространен на другие молекулы.
Метод валентных связей.
Обычно используют приближенные методы расчета двух- и многоатомных систем с ковалентной связью: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Метод ВС базируется на следующих основных положениях:
Химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар (обобществление двух электронов);
Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
характеристики химической связи (энергия, длина, полярность и др.) определяется типом перекрывания АО.
С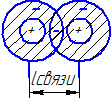 войства
ковалентной связи:
прочность связи, полярность связи,
насыщенность связи, направленность.
войства
ковалентной связи:
прочность связи, полярность связи,
насыщенность связи, направленность.
П рочность
определяется энергией, которая выделяется
при образовании связи (кДж/моль), а также
длинной связи.
Длина
связи
это расстояние между ядрами отдельных
атомов в устойчивом состоянии. При таком
состоянии выделяется энергия, называемая
энергией связи Есв.
Чем больше длина связи, тем прочность
связи меньше, выражается в «А0»,нм.
Ковалентные связи очень прочные, т. к.
происходит взаимодействие вплоть до
отталкивания ядер (близкодействие), она
определяется также кратностью связи,
т. е. числом электронных пар, участвующих
в связи. Н-Н, О=О, N≡N.
рочность
определяется энергией, которая выделяется
при образовании связи (кДж/моль), а также
длинной связи.
Длина
связи
это расстояние между ядрами отдельных
атомов в устойчивом состоянии. При таком
состоянии выделяется энергия, называемая
энергией связи Есв.
Чем больше длина связи, тем прочность
связи меньше, выражается в «А0»,нм.
Ковалентные связи очень прочные, т. к.
происходит взаимодействие вплоть до
отталкивания ядер (близкодействие), она
определяется также кратностью связи,
т. е. числом электронных пар, участвующих
в связи. Н-Н, О=О, N≡N.
Полярность связи. Если два атома обладают одинаковой электроотрицательностью, то область перекрывания находится посередине между ядрами. Такая связь неполярная
Если
один из атомов обладает большей
электроотрицательностью, то область
перекрывания смещается в сторону более
электроотрицательного элемента.
Возникают два полюся «+» и «-», то есть
диполь.

![]() -
диполь.
– диполь
-
диполь.
– диполь
Т![]() аким
образом, полярность в молекуле связи
связана со смещением области перекрывания
в сторону более электроотрицательного
элемента. Полярность выражается величиной
дипольного момента связи: P=l*ē.
Измеряется в Кл/м
или Дебай.
аким
образом, полярность в молекуле связи
связана со смещением области перекрывания
в сторону более электроотрицательного
элемента. Полярность выражается величиной
дипольного момента связи: P=l*ē.
Измеряется в Кл/м
или Дебай.
l – расстояние между центрами тяжести положительных и отрицательных зарядов.
ē - заряд электрона
Р – дипольный момент связи.
1 Дебай = 3,3*10-30 Кл/м.
Если в молекуле несколько связей, то в целом молекула может быть, как полярной, так и не полярной.
Н асыщаемость
– определенный предел способности
атома, присоединять к себе другие атомы.
Ковалентная связь насыщаема, так как в
связи участвуют валентные электроны,
а их число строк ограничено.
асыщаемость
– определенный предел способности
атома, присоединять к себе другие атомы.
Ковалентная связь насыщаема, так как в
связи участвуют валентные электроны,
а их число строк ограничено.

Направленность связи. Ковалентная связь в молекуле направлена. Она осуществляется за счет перекрывания валентных орбиталей, а области «х» - это заряженное поле. Согласно модели Гиллеспи: один атом является центральным, а остальные боковым, чтобы образовалась устойчивая молекула.
О бменный
и донорно-акцепторный механизм образования
ковалентной связи.
бменный
и донорно-акцепторный механизм образования
ковалентной связи.
Согласно обменному механизму, каждый атом отдает на образование общей электронной пары по одному неспаренному электрону.
С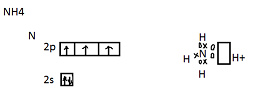 ледует
учитывать, что общая электронная пара
образуется не только по обменному
варианту, но и по донорно-акцепторному
варианту.
Каждый атом водорода отдает на связь
по одному неспаренному электрону. Донор
отдает на связь оба электрона, акцептор
дает свободную орбиталь и оба электрона
становятся общими.
ледует
учитывать, что общая электронная пара
образуется не только по обменному
варианту, но и по донорно-акцепторному
варианту.
Каждый атом водорода отдает на связь
по одному неспаренному электрону. Донор
отдает на связь оба электрона, акцептор
дает свободную орбиталь и оба электрона
становятся общими.
Понятие о возбуждении и гибридизации электронов.
Гибридизация – процесс перераспределения валентных орбиталей центрального атома и выравнивания их по форме и энергии с целью образования устойчивой молекулы.
Рассмотрим расположение областей перекрывания относительно осей связей. Ось перекрывания – это воображаемая линия, проходящая через ядра атомов в молекуле.
Е

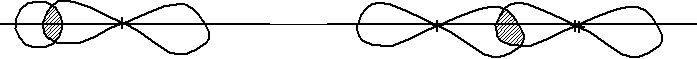 сли
область перекрывания находится на оси
связи, такая связь называется сигма
(ᵹ) связью.
сли
область перекрывания находится на оси
связи, такая связь называется сигма
(ᵹ) связью.

Если область перекрывания не находится на оси связи, а находится по обе стороны от нее, то это π связь.
Е
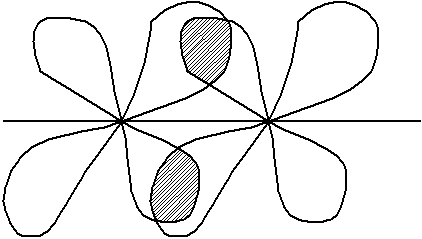 сли
перекрываются d-орбитали,
это (Δ)дельта связь
сли
перекрываются d-орбитали,
это (Δ)дельта связь
Алгоритм построения молекул с учетом гибридизации электронов на примере молекул: H2S, MgCl2, AsH3, CCl4.
Алгоритм построения молекулы:
Выбираем центральный атом и выписываем из него валентные электроны.
перевести в возбужденное состояние.
подписываем клеточки.
Складываем их в строчку.
рисуем оси.
наносим на них гибридные облака
Проводим соседние атомы.
Указываем тип гибридизации, валентный угол, форму молекулы, полярность связи и полярность молекулы в целом.
 Комплексные
соединения: строение, характер химических
связей между составными частями,
диссоциация.
Комплексные
соединения: строение, характер химических
связей между составными частями,
диссоциация.
Координационным или комплексным называют соединение, содержащее в своем составе положительно или отрицательно заряженный сложный ион, способный к существованию как в кристалле так и в растворе.
Схема комплексной молекулы.
Число показывающее, сколько лигандов присоединено (скоординировано) к центральному атому – комплексообразователю, называется координационным числом комплексообразователя. Комплексное соединение, растворяясь в воде и других полярных растворителях, подвергается электролитической диссоциации с образованием устойчивых комплексных ионов, образующих врутреннюю сферу молекулы. [Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-
Ионы внешней сферы комплексной молекулы связаны с центральным атомом ионной связью. Благодаря электростатической связи ионы внешней сферы подвергаются электролитической диссоциации под действием полярных молекул растворителя, например воды. Лиганды же не разрывают связь с атомом комплексообразователя в полярном растворителе, что свидетельствует о ковалентном характере связи лигандов с центральным атомом. Эта связь объясняется донорно-акцепторной схемой теории валентной связи, центральный атом служит акцептором, а Лиганды доноры электронной пары.
Таким образом, химическая связь в координационном соединении представляет совокупность ковалентной и ионной связи. Получают комплексные соединения обычными методами химического синтеза: реакцией ионного обмена, присоединения, вытеснения и т.п. Основным условием является обеспечение прочной связи лигандов с центральным атомом.
Отличие от двойных солей.
Двойные соли имеют сложный состав, как и комплексные соединения. Например, кристаллический сульфат железа (II) аммония, называемый солью Мора. (NH4)2Fe(SO4)26H2O. В отличие от комплексного соединения, двойная соль диссоциирует на все «простые» ионы, входящие в ее 7. Ионная связь и ее свойства: насыщаемость, направленность, полярность.
И онная
связь образуется между атомами, которые
максимально отличаются по
электроотрицательности. Это элементы
1а и 7а групп. Ионная связь обусловлена
электростатическим кулоновским
взаимодействием полей разноименно
заряженных ионов. Ионная связь не очень
прочная так как ионы действую на большом
расстоянии. Так как поле иона Na+
имеет сферическую симметрию, то ион Cl
- может
подойти с любой стороны то есть ионная
связь не направлена.
Несмотря на то, что Na
имеет один валентный электрон к ионному
Na+
могут подойти много ионов Cl
-,
то ее ионная связь не насыщенна. Ионная
связь является, в крайнем случае, полярной
связью. Она полярна уже по своей сути,
нет четкого разделения между ионной и
ковалентной связью.
онная
связь образуется между атомами, которые
максимально отличаются по
электроотрицательности. Это элементы
1а и 7а групп. Ионная связь обусловлена
электростатическим кулоновским
взаимодействием полей разноименно
заряженных ионов. Ионная связь не очень
прочная так как ионы действую на большом
расстоянии. Так как поле иона Na+
имеет сферическую симметрию, то ион Cl
- может
подойти с любой стороны то есть ионная
связь не направлена.
Несмотря на то, что Na
имеет один валентный электрон к ионному
Na+
могут подойти много ионов Cl
-,
то ее ионная связь не насыщенна. Ионная
связь является, в крайнем случае, полярной
связью. Она полярна уже по своей сути,
нет четкого разделения между ионной и
ковалентной связью.
Сопоставление с ковалентной связью. Ионная связь по сравнению с ковалентной менее прочная, т.к. ионы действую на большом расстоянии. Ионная связь в отличие ковалентной характеризуется ненаправленностью. В отличие от ковалентной ионная связь характеризуется также не насыщаемостью.
