
*1-Липофильные протеиногенные аминокислоты.
Глицин NH2-CH2-COOH(GLY) Валин NH2-CH-COOH(VAL) Аланин NH2-CH-COOH(ALA)
CH3-CH-CH3 CH3
Изолейцин NH2-CH-COOH(ILE) Лейцин NH2-CH-COOH(LEU) Фенилаланин NH2-CH-COOH(PHE)


 CH-CH3
CH3-CH-CH3
CH2
CH-CH3
CH3-CH-CH3
CH2
CH3-CH2
П
 ролин
Триптафан
NH2-CH-COOH(THP)
ролин
Триптафан
NH2-CH-COOH(THP)

 COOH(PRO)
CH2
COOH(PRO)
CH2
 N
NH
N
NH






 H
H
2-Кислотные протеиногенные аминокислоты.
Аспарагиновая кислота NH2-CH-COOH(ASP) Глутаминовая кислота NH2-CH-COOH(GLU)
CH2-COOH CH2
CH2-COOH
3-Основные протеиногенные аминокислоты.
Л


 изин
NH2-CH-COOH(LUS) Гистидин
N COOH (HIS)
изин
NH2-CH-COOH(LUS) Гистидин
N COOH (HIS)
(

 CH2)4
N CH2-CH
CH2)4
N CH2-CH
NH2 H NH2
Аргенин NH2-CH-COOH(ARG)
(CH2)3
NH
NH2-C=NH
4-Структурные признаки протеиногенных аминокислот. Примеры.
-все являются α-аминокислотами
-все,кроме GLY содержат ассиметрический атом углерода и имеют L-конфигурацию
α
Пример: серин NH2-CH-COOH COOH
CH2 NH2-C-H
OH CH2
OH L-форма
Аминокислоты-гетерофункцинальные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу.
5-Незаменимые аминокислоты:
Валин(VAL) NH2-CH-COOH Лейцин(LEU) NH2-CH-COOH Изолейцин NH2-CH-COOH
CH3-CH-CH3 CH2 CH-CH3
CH3-CH-CH3 CH2-CH3
Фенилаланин NH2-CH-COOH(PHE) Тирозин (Tyz) NH2-CH-COOH Триптафан NH2-CH-COOH(THP)



 CH2
CH2
OH CH2
CH2
CH2
OH CH2

 NH
NH
М
 етионин(Met)
NH2-CH-COOH
Лизин,аргенин,гистидин
етионин(Met)
NH2-CH-COOH
Лизин,аргенин,гистидин
(CH2)2
S-CH3
6-Метаболитные аминокислоты.
СOOH
Г
 омоцистеин
HS-CH2-CH2-CH
NH2
β-Аланин NH2-CH2-CH2-COOH
омоцистеин
HS-CH2-CH2-CH
NH2
β-Аланин NH2-CH2-CH2-COOH
COOH ГАМК NH2-CH2-CH2-CH2-COOH
О рнитин
NH2-(CH2)3 CH NH2 Таурин
NH2-CH2-CH2-SO3H
рнитин
NH2-(CH2)3 CH NH2 Таурин
NH2-CH2-CH2-SO3H
 COOH
COOH
Г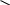 омосерин
HO-(CH2)2-CH NH2
омосерин
HO-(CH2)2-CH NH2
COOH
Ц итрулин NH2-CO-NH-(CH2)3-CH NH2
7-Химические свойства α-аминокис-ого фрагмента:
1
 -реа-ии
по -СООН группе-R-CH-COOH
R-CH-COO+H
pH<7
-реа-ии
по -СООН группе-R-CH-COOH
R-CH-COO+H
pH<7
NH2 NH2
-

 R-CH-COOH
R-OH
R-CO-O-R
сложные эфиры -R-CH-COOH
NAOH
R-CH-COONA+H2O
соль
R-CH-COOH
R-OH
R-CO-O-R
сложные эфиры -R-CH-COOH
NAOH
R-CH-COONA+H2O
соль
NH2 NH2 NH2
R -CH-COOH
R-NH2
R-CH-C
NH-R
замещенные амиды
-CH-COOH
R-NH2
R-CH-C
NH-R
замещенные амиды
NH2 NH2
2
 -по
-NH2
фрагменту –R-CH-COOH
R-CH-COOH
pH
>7
-по
-NH2
фрагменту –R-CH-COOH
R-CH-COOH
pH
>7
NH2 NH3
R

 -CH-COOH+R-CO-R
R-CH-COOH
R-CH-COOH+HCL [R-CH-COOH]CL соль
+H2O
-CH-COOH+R-CO-R
R-CH-COOH
R-CH-COOH+HCL [R-CH-COOH]CL соль
+H2O
NH2 N=C азометины NH2 NH3
3 -образов-ие
пептидных
связей:
-R-CH-COOH+R-CH-COOH R-CH-CO-NH-CH-R
-образов-ие
пептидных
связей:
-R-CH-COOH+R-CH-COOH R-CH-CO-NH-CH-R
NH2 NH2 NH2 COOH
4-дезаминирование,5-декарбоксилирование,6-трансаминирование
8-Классификация аминокислот по боковому радикалу:
П

 О
боковому радикалу
О
боковому радикалу
Липофильные:(ALa,VAL,LEU,ILE,
P he,Pro,Met,Trp,Gly
)
полярные
катионообразующие(Arg,His,Lus)
he,Pro,Met,Trp,Gly
)
полярные
катионообразующие(Arg,His,Lus)
Анионообраз-ие (Asp, Glu) незаряженные,но полярные (Asn,Ser,Tyr,
Thr(треон),Cys,Gln)
9 -Виды связей в белковых молекулах: 2 группы:
КОВАЛЕНТНЫЕ СВЯЗИ - обычные прочные химические связи.а) пептидная связь б) дисульфидная связь 2. НЕКОВАЛЕНТНЫЕ (СЛАБЫЕ) ТИПЫ СВЯЗЕЙ - физико-химические взаимодействия родственных структур. В десятки раз слабее обычной химической связи. Очень чувствительны к физико-химическим условиям среды. Они неспецифичны, то есть соединяются друг с другом не строго определенные химические группировки, а самые разнообразные химические группы, но отвечающие определенным требованиям.а) Водородная связь б) Ионная связь в) Гидрофобное взаимодействие
ПЕПТИДНАЯ СВЯЗЬ.-Формируется за счет COOH-группы одной аминокислоты и NH2-группы соседней аминокислоты. В названии пептида окончания названий всех аминокислот, кроме последней, находящейся на «С»-конце молекулы меняются на «ил»
ПЕПТИДНАЯ СВЯЗЬ формируется ТОЛЬКО ЗА СЧЕТ АЛЬФА-АМИНОГРУППЫ И СОСЕДНЕЙ COOH-ГРУППЫ ОБЩЕГО ДЛЯ ВСЕХ АМИНОКИСЛОТ ФРАГМЕНТА МОЛЕКУЛЫ!!! Если карбоксильные и аминогруппы входят в состав радикала, то они никогда(!) не участвуют в формировании пептидной связи в молекуле белка. Хотя пептидная связь довольно прочная, ее сравнительно легко можно разрушить химическим путем – кипячением белка в крепком растворе кислоты или щелочи в течении 1-3 суток.ДИСУЛЬФИДНАЯ СВЯЗЬ.Цистеин - аминокислота, которая в радикале имеет SH-группу, за счет которой и образуются дисульфидные связи.Дисульфидная связь - это ковалентная связь. Однако биологически она гораздо менее устойчива, чем пептидная связь. Это объясняется тем, что в организме интенсивно протекают окислительно-восстановительные процессы. Дисульфидная связь может возникать между разными участками одной и той же полипептидной цепи, тогда она удерживает эту цепь в изогнутом состоянии. Если дисульфидная связь возникает между двумя полипептидами, то она объединяет их в одну молекулу.
Слабые типы связей
В десятки раз слабее ковалентных связей. Это не определенные типы связей, а неспецифическое взаимодействие, которое возникает между разными химическими группировками, имеющими высокое сродство друг к другу (сродство – это способность к взаимодействию). Например: противоположно заряженные радикалы.Таким образом, слабые типы связей - это физико-химические взаимодействия. Поэтому они очень чувствительны к изменениям условий среды (температуры, pH среды, ионной силы раствора и так далее). ВОДОРОДНАЯ СВЯЗЬ - это связь, возникающая между двумя электроотрицательными атомами за счет атома водорода, который соединен с одним из электроотрицательных атомов ковалентно (см. рисунок).Водородная связь примерно в 10 раз слабее, чем ковалентная. Если водородные связи повторяются многократно, то они удерживают полипептидные цепочки с высокой прочностью. Водородные связи очень чувствительны к условиям внешней среды и присутствию в ней веществ, которые сами способны образовывать такие связи (например, мочевина).ИОННАЯ СВЯЗЬ - возникает между положительно и отрицательно заряженными группировками (дополнительные карбоксильные и аминогруппы), которые встречаются в радикалах лизина, аргинина, гистидина, аспарагиновой и глутаминовой кислот.ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ - неспецифическое притяжение, возникающее в молекуле белка между радикалами гидрофобных аминокислот - вызывается силами Ван-дер-Ваальса и дополняется выталкивающей силой воды. Гидрофобное взаимодействие ослабевает или разрывается в присутствии различных органических растворителей и некоторых детергентов. Например, некоторые последствия действия этилового спирта при проникновении его внутрь организма обусловлены тем, что под его влиянием ослабляются гидрофобные взаимодействия в молекулах белков.
10-Первичные,вторичная,третичная структуры белковых молекул:
Первичная структура
Первичная структура белка - последовательность аминокислотных фрагментов, прочно соединенных пептидными связями.Если произошел разрыв хотя бы одной пептидной связи, то образуется уже другой белок.Важным здесь явл-ся кол-во,качество и послед-ть аминок-т.
NH-CH2-CO-NH-CH-CO-NH-CH-CO
Вторичная структура
Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
1) Альфа-спираль - имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
Б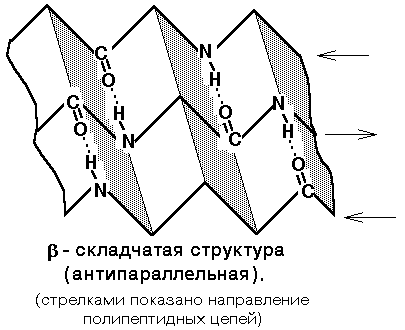
 ета-складчатая
структура
- или структура складчатого листа.
Фиксируется также водородными связями
между С=О и NH-группами. Фиксирует два
участка полипептидной цепи. Эти цепи
могут быть параллельны или антипараллельны.
Если такие связи образуются в пределах
одного пептида, то они всегда
антипараллельны, а если между разными
полипептидами, то параллельны.
ета-складчатая
структура
- или структура складчатого листа.
Фиксируется также водородными связями
между С=О и NH-группами. Фиксирует два
участка полипептидной цепи. Эти цепи
могут быть параллельны или антипараллельны.
Если такие связи образуются в пределах
одного пептида, то они всегда
антипараллельны, а если между разными
полипептидами, то параллельны.
3) Нерегулярная структура - тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
ТРЕТИЧНАЯ СТРУКТУРА-Это трехмерная архитектура полипептидной цепи – особое взаимное расположение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. У разных белков третичной структуры различна. В формировании третичной структуры участвуют дисульфидные связи и все слабые типы связей.
Выделяют два общих типа третичной структуры:1) В фибриллярных белках (например, коллаген, эластин) молекулы которых имеют вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами.2) В глобулярных белках, молекулы которых имеют форму шара или эллипса (латинское название: GLOBULA - шар), встречается сочетание всех трех типов структур: всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
