
- •Условия эксплуатации автотракторного электрооборудования. Основные технические требования
- •Основные технические требования, предъявляемые к автотракторному электрооборудованию
- •Условные обозначения изделий электрооборудования
- •Лекция 2 Системы электропитания Общие сведения о системах электропитания автомобилей и тракторов
- •Лекция 3 Автомобильные генераторы
- •Принцип работы генератора переменного тока
- •Природа индукционного тока сила Лоренца
- •Принцип действия синхронного генератора
- •Основные понятия об обмотках статора
- •Электродвижущая сила катушки
- •Автомобильные вентильные генераторы с клювообразным ротором
- •Характеристики вентильных генераторов.
- •Характеристика холостого хода
- •Внешние характеристики
- •Токоскоростная характеристика
- •Регулировочно-скоростные характеристики
- •Конструкция автомобильного вентильного генератора
- •Вентильные генераторы индукторного типа
- •Лекция 4 Регулирование напряжения автотракторных генераторов
- •Бесконтактные регуляторы напряжения
- •Полупроводниковый диод.
- •Стабилитрон.
- •Транзистор
- •Тиристор
- •Бесконтактные транзисторные регуляторы напряжения
- •Транзисторный регулятор напряжения с коллекторной обратной связью.
- •Температурная стабильность полупроводниковых регуляторов напряжения.
- •Конструкция полупроводниковых регуляторов напряжения
- •Расчет регуляторов напряжения
- •Лекция 5 Аккумуляторные батареи. Назначение. Основные требования
- •Электролитическая проводимость.
- •Принцип работы. Основные электрохимические процессы в свинцово – кислотной батарее
- •Характеристики аккумуляторных батарей
- •Способы заряда аккумуляторных батарей.
- •Параллельная работа генератора и аб.
- •Лекция 6 Системы электростартерного пуска
- •Пусковые мощность, момент сопротивления, частота вращения
- •Структурная схема системы электростартерного пуска.
- •Передаточное число привода от стартера к двигателю.
- •Электродвигатели постоянного тока
- •Правило левой руки
- •Правило правой руки
- •Рамка с током в магнитно поле.
- •Постоянная эдс
- •Основы, теорий электрических стартеров
- •Конструкция и принцип работы электростартеров
- •Схемы управления электростартерами.
- •Основные характеристики аккумуляторных батарей в режиме пуска двс
- •Методика подбора электропусковой системы двигателя внутреннего сгорания.
- •Лекция 7 Системы зажигания Общие сведения о системах зажигания
- •Теория батарейного зажигания Закон электромагнитной индукции Фарадея
- •Взаимоиндукция
- •Замыкание контактов прерывателя (процесс нкопления энергии)
- •Размыкание контактов прерывателя
- •Пробой искрового промежутка свечи
- •Пробой искрового промежутка свечи
- •Вольт-амперная характеристика протекания электрического разряда в газовом промежутке
- •Достоинства и недостатки контактной системы зажигания
- •Конструкция элементов системы батарейного зажигания Свечи зажигания
- •Катушка зажигания
- •Прерыватель-распределитель
- •Электронные батарейные системы зажигания
- •Бесконтактная транзисторная система зажигания.
- •Система зажигания с накоплением энергии в емкости.
- •Системы зажигания от магнето
- •Требования к системам зажигания. Основные параметры
- •Расчет элементов батарейной системы зажигания Катушка зажигания.
- •Расчет электромагнитных параметров катушки зажигания.
- •Лекция 8 Информационная система Общие сведения
- •Цифровая информационная система
- •Визуальные индикаторы
- •Лекция 9 Система освещения автомобилей и тракторов
- •Классификация систем освещения
- •Фары с европейской системой светораспределения
- •Светосигнальные фонари
- •Лекция 10 Электрические сети автомобиля
- •Растет электрической цепи автомобиля
- •Контакты
Электролитическая проводимость.
Электрические заряды текут по проводникам одним из двух способов. Первый – движение электронов, этот способ имеет место в металлах. Второй – движение ионов в электролитах. Серная кислота (H2SO4) смешанная с водой диссоциирует на два положительных иона (катион) 2H+ и отрицательный ион (анион) SO4-. При этом положительные ионы притягиваются к отрицательному электроду, а отрицательные к положительному. Это движение известно как ионный ток, или дрейф ионов.
Сопротивление электролита.
Сопротивление любого вещества зависит от следующих параметров:
природы вещества;
температуры;
длины;
площади поперечного сечения.
Это верно и для электролита. Однако в отличие от металлов, которые имеют положительный температурный коэффициент сопротивления (с увеличением температуры удельное сопротивление растет), электролиты имеют отрицательный температурный коэффициент сопротивления (с увеличением температуры удельное сопротивление падает).
Принцип работы. Основные электрохимические процессы в свинцово – кислотной батарее
Работа аккумулятора основана на принципе, открытом еще в средние века: между двумя разными металлами, помещенными в кислый раствор, возникает электрическое напряжение. Если выводы металлов с помощью проводника соединить с потребителем, то по проводнику потечет электрический ток, внутри же аккумулятора начинается химическая реакция.
При погружении электрода выполненных из губчатого свинца (Pb) в раствор электролита ионы метала (как известно, в кристаллической решетке металлов находятся как атомы, так и ионы, связанные подвижным равновесием) под действием электрохимической разности потенциалов переходят в раствор, заряжая его положительно, а электрод будет иметь избыток электронов и, следовательно, преобретет отрицательный заряд. Появление отрицательного заряда на электроде препятствует выходу положительно заряженных ионов (катионов) в раствор, часть же катионов из раствора, взаимодействуя с электронами, входят в узлы кристаллической решетки металла, которую они покинули. При достижении равенства скоростей выхода катионов в раствор и их вхождением в металл устанавливается динамическое равновесие. В результате переход ионов свинца в раствор (растворение свинца) прекратится.
При погружении электрода в электролит выполненного из перекиси свинца (PbO2), который является малоактивным и как следствие окисление электрода происходит с трудом, в то время как катионы из раствора активно осаждаются на поверхность электрода. Электрод в этом случае заряжается положительно, а раствор отрицательно, из-за избытка оставшихся в нем отрицательно заряженных ионов (анионов). Между электродами образуется разность потенциалов величиной примерно 2В.
Элементарный свинцово-кислотный элемент представляет собой сосуд с электролитом. В этот раствор помещают 2 пластины. В заряженном аккумуляторе активная масса положительных электродов состоит из перекиси свинца РЬО2 темно-коричневого цвета, а активная масса отрицательных электродов — из губчатого свинца серого цвета. Плотность электролита зависит от района эксплуатации батарей, она колеблется в пределах 1,22— 1,30 г/см3 при 25°С.
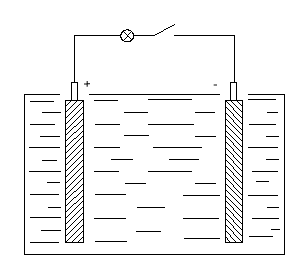
Рис. 8.2. Элементарный свинцово-кислотный элемент
При замыкании цепи, во внешней цепи ток идёт от положительной клеммы к отрицательной, то есть от «+» пластины к «-». При этом будет происходить химическая реакция с отдачей электроэнергии на питание нагрузки. Кислота начинает взаимодействовать со свинцовыми пластинами. Перекись свинца PbO2 положительной пластины и пористый свинец Pb отрицательной пластины превращаются в сернокислый свинец PbSO4 или сульфат свинца. Электролит, в свою очередь, теряя кислоту, повышает содержание воды и удельный его вес (плотность) уменьшается. Эмпирически установлено, что зависимоть напряжения элемента от плотности электролита определяется формулой,
E = 0,84 + ρ,
где ρ – относительная плотность электролита, г/см³.
Таблица 8.1
Относительная плотность электролита, г/см³ (ρ) |
Напряжение одного элемента, В (E = 0,84 + ρ) |
Напряжение всей батареи, В (Eаб = mE) |
Степень заряда,% |
1,28 |
0,84 + 1,28 = 2,12 |
6 × 2,12 = 12,7 |
100 |
1,24 |
0,84 + 1,24 = 2,08 |
6 × 2,08 = 12,5 |
70 |
1,20 |
0,84 +1,20 = 2,04 |
6 × 2,04 = 12,3 |
50 |
1,15 |
0,84 + 1,15 = 1,99 |
6 ×1,99 = 12,0 |
20 |
1,12 |
0,84 + 1,12 = 1,96 |
6 × 1,96 = 11,8 |
0 |
АК полностью разрядится, когда свинец Pb и перекись свинца PbO2 превратятся в сернокислый свинец PbSO4 или сульфат свинца, химический процесс прекратится. Процесс превращения химической энергии в электрическую можно назвать разрядом. Так как в процессе разряда серная кислота идет на образование сульфата свинца при одновременном выделении воды плотность электролита при 100%-ном разряде уменьшается примерно на 0,16 г/см3. Снижение плотности электролита на 0,01 г/см3 соответствует снижению емкости аккумулятора или увеличению степени разряженности примерно на 6%. По плотности электролита можно сделать заключение о степени разряженности аккумулятора. Из практики известно, что нельзя допускать снижение напряжения свинцово-кислотного элемента ниже 1,8 В, так как электролит при этом имеет тенденцию превратиться в чистоую воду, а на пластинах заметно вырастают кристаллы свинца, при образовании которых трудно перезарядить АБ. Для того, чтобы разряженный элемент привести вновь в рабочее состояние, его нужно зарядить, то есть аккумулятор включают в цепь параллельно источнику постоянного тока (генератору, выпрямителю), напряжение которого должно превышать ЭДС заряжаемого аккумулятора. Для этого к положительной пластине АКБ надо присоединить плюс источника тока, а к отрицательной – минус. И ток во внутренней цепи пойдёт от положительной пластины к отрицательной. Под действием тока при зарядке химические реакции пойдут в обратном направлении. Кислотный остаток SO4 сернокислого свинца обеих пластин и водород воды восстанавливают кислоту в электролите (H2 + SO4→H2SO4), происходит выделение кислоты и поглощение воды. А за счёт кислорода воды образуется перекись свинца на положительной пластине, а на отрицательной – чистый губчатый свинец, то есть состав пластин восстанавливается. Как только активная масса электродов преобразуется в двуокись свинца и губчатый свинец, плотность электролита перестает повышаться, что служит признаком конца заряда аккумулятора. Удельный вес электролита повышается, следовательно, напряжение на клеммах элемента будет расти, то есть процесс, при котором электроэнергия превращается, в химическую энергию, называется зарядом. При дальнейшем заряде аккумулятора будет происходить только разложение воды на водород и кислород. Обильное газовыделение вызывает сильное «кипение» электролита. Такое явление нежелательно, так как кроме перерасхода электрической энергии оно вызывает снижение срока службы аккумулятора.
