
- •18.Обратимые и необратимые процессы.Неравноценность теплоты и работы.Второе начало термодинамики.
- •19. Циклы.Цикл Карно и его коэф полезного действия. Термодинамическая шкала температур.
- •20.Приведенная теплота. Энтропия. Математическая формулировка 2 начала термодинамики.
- •21. Макросистемы. Понятие о вероятности. Функция распределения.
- •22. Функции распределения молекул по скоростям. Распр Максвелла и его анализ.
- •23. Скорости газовых мол. Внутренняя энергия идеал газа.
- •24. Распределение Больцмана. Распр Максвелла-Больцмана.
19. Циклы.Цикл Карно и его коэф полезного действия. Термодинамическая шкала температур.
Цикл-наз процесс,при кот система,пройдя через ряд состояний,возр в исхизобр в виде замкнутой кривой.цикл,сов идеал газом можно разбить на процесс расширения и сжатия. прямой(если за цикл сов пол -протек по час стрелке),так и в обратный(если сов отр -цикл протек против час стрелки).
Цикл Карно- идеал
термодинамич цикл.Тепл машина Карно,работ
по этому циклу, облад макс КПД из всех
машин,у кот макс и мин темпер осуществл
цикла совпад соответс с макс и мин темпер
цикла Карно.Состоит из 2 адиабатических
и 2 изотермических процессов.Одним из
важных св-в цикла Карно явл его
обратимость:он может быть провед как в
прямом,как и в обратн направ,при этом
энтропия адиабатически изолированной(без
теплообмена с окр средой) системы не
меняется. Цикл Карно состоит из
четырёх стадий:1.Изотермическое расшир
(на рис — процесс A→Б). В начале процесса
раб тело имеет темп TН,то есть темп
нагрев.Затем тело прив в контакт с
нагревателем,кот изотермически(при
пост темпер)передему кол-во теплоты
QН.При этом объём рабочего тела
↑.2.Адиабатическое(изоэнтропическое)расшир
(на рис процесс Б→В).Раб тело отсоед от
нагрев и продол расшир без теплообм с
окрй средой.При этом его темпер ↓до
темпер холодильника.3.Изотермическое
сжатие(на рис процесс В→Г).Раб тело,
имеющ к тому врем темпер Tх, прив
в контакт с холодил и начинает изотермически
сжиматься,отдавая холодильнику кол-во
теплоты Qх.4.Адиабатическое(изоэнтропическое)сжатие
(на рис процесс Г→А).Рабтело отсоед от
холодил и сжим без теплообм с окр
средой.При этом его темпер ↑ до темпер
нагревателя. При изотерм процессах
темпер остаётся постоянной,при адиабат
отсут теплообм,а значит, сохраняется
энтропия:
![]() при
при
![]() .Поэтому
цикл Карно удобно предст в координатах
T и S.
.Поэтому
цикл Карно удобно предст в координатах
T и S.
КПД тепловой машины Карно:Кол-во
теплоты,пол раб телом от нагрев при
изотермич расшир, равно![]() .При
изотермич сжатии рабтело отдало
холодил
.При
изотермич сжатии рабтело отдало
холодил![]() Отсюда
коэффициент
полезного действия Карно:
Отсюда
коэффициент
полезного действия Карно:
![]()
Из посл выраж видно,что КПД тепловой машины Карно зав только от Т нагр-ля и хол-ка, КПД может состав 100 % только в том случае,если Т хол-ка равна 0.Это невозможно,но не из-за недостиж абс нуля,а из-за того,что такой цикл или нельзя замкнуть, или он вырожд в совок 2-х совпад адиабат и изотерм.Поэтому макс КПД любой тепловой машины будет < или = КПД тепловой машины Карно,раб при тех же Т нагр-ля и хол-ка.
Термодинамическая шкала температур (Кельвина шкала) - абсол шкала темпер,не зав от св-в термометр в-ва(начало отсчета - абсолютный нуль температуры).Постр термодинам температ шкалы основано на втором начале термодинамики и,в частности,на независ кпд Карно цикла от природы рабтела.Единица термодин темп - кельвин (К) - определяется как 1/273,16 часть термод темпер тройной точки воды.
20.Приведенная теплота. Энтропия. Математическая формулировка 2 начала термодинамики.
Приведенная
теплота-Из цикла Карно видно,что =
между собой отнош Q к Т,при
кот они были пол или отданы в изотермическом
процессе:
![]()
|
|
Отнош теплоты
Q в изотермическом процессе Т,при кот
происх передача Q, называется
приведенной теплотой
![]() :
:
![]() Для
подсчета приведенной теплоты в
произвольном процессе необх разбить
этот процесс на бесконечно малые участки,
где Т можно считать константой. Приведенная
теплота на таком участке будет равна
Для
подсчета приведенной теплоты в
произвольном процессе необх разбить
этот процесс на бесконечно малые участки,
где Т можно считать константой. Приведенная
теплота на таком участке будет равна
![]() .Суммируя
на всех участках процесса, получим:
.Суммируя
на всех участках процесса, получим:
![]()
Тогда в
обратимом цикле Карно имеем:
![]()
|
|
|
|
Этот результат
справедлив для любого обратимого
процесса.Таким образом, для процесса,
происх по замкнутому циклу
![]()
Из рав-ва
нулю интеграла,взятого по замкн
контуру,следует, что подынтегр выр
![]() есть
полный дифференциал некот фу-и,кот опред
только состоян системы и не зав от пути,
каким система пришла в это состояние.Это
позвол ввести новую фу-ю состояния S:
есть
полный дифференциал некот фу-и,кот опред
только состоян системы и не зав от пути,
каким система пришла в это состояние.Это
позвол ввести новую фу-ю состояния S:
![]()
|
Ф-ия состояния,полный дифференциал кот равен , наз энтропией– мера способности теплоты превращаться в другие виды энергии. Энтропия S – это отнош пол или отданной Q к Т, при кот происх этот процесс.Пон S впервые введено Р. Клаузиусом в 1854 г. Энтропия-функция состояния,диф которого явл ∂Q/T. Для обр процессов:∂S=0, необрат цикл:∂S>0 это только для замкн системы,если же система обменивается теплотой с внеш средой,то ее S может вести себя любым образом. Соотн формул можно предст в виде неравенства Кл-са:∂S≥0,т.е. S замкн системы может либо возр(необр процесс),либо конст(обратн процесс).
Если
система сов равновесный переход из сост
1 в2,то: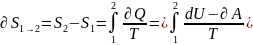 ,опр
S
лишь с точностью до аддитивной
постоянной.физ смысл имеет не сама S,а
разность ее.найдем изм в процессах идеал
газа,т.к.
,опр
S
лишь с точностью до аддитивной
постоянной.физ смысл имеет не сама S,а
разность ее.найдем изм в процессах идеал
газа,т.к.
 ,то
,то
 или
или
 ,т.е.изм
S
идел газа при переходе из 1 в2 не зав от
вида процесса перехода 1→2.т.к. для адиаб
процесса
,т.е.изм
S
идел газа при переходе из 1 в2 не зав от
вида процесса перехода 1→2.т.к. для адиаб
процесса
 и S-const,т.е.
адиаб обрат процесс протек при пост
S-изоэнтропический
процесс. при изотерм процессе Т1=Т2:
и S-const,т.е.
адиаб обрат процесс протек при пост
S-изоэнтропический
процесс. при изотерм процессе Т1=Т2: ,
при изохорном процессе V1=V2:
,
при изохорном процессе V1=V2:
 .
Обладает св-вом аддитивности:энтр
системы =сумме энтр тел,вход в систему.
.
Обладает св-вом аддитивности:энтр
системы =сумме энтр тел,вход в систему.
Математическая формулировка 2 начала термодинамики:
