
- •5. Максвелл
- •6 Уравнение состояние идеального газа
- •7. Распределение Больцмана
- •8. Что такое процесс? Обратимый. Необратимый, равновесный процесс
- •9. Первое начало термодинамики
- •Первый закон термодинамики для изопроцессов
- •11.Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
2. равновесное состояние
РАВНОВЕСНОЕ СОСТОЯНИЕ - состояние, в которое приходит термодинамич. система при постоянных внеш. Условиях. характеризуется постоянством во времени термодинамич. параметров и отсутствием в системе потоков вещества и энергии.
3. макроскопические параметры
Макроскопические параметры- параметры больших масштабов (масса газа, давление, обьем, температура)
4. модель идеального газа
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В этой модели газ рассматривается в виде совокупности молекул — шариков очень малых размеров и почти не взаимодействующих между собой, т.е. при рассмотрении законов идеального газа пренебрегают собственным объемом молекул (по сравнению с объемом сосуда, в котором он находится) и силами их взаимного притяжения; при соударениях молекул друг с другом и со стенками сосуда действуют силы упругого отталкивания. Идеального газа в природе не существует — это упрощенная модель реального газа.
Реальный газ становится близким по свойствам к идеальному, когда он достаточно нагрет и разрежен. Некоторые газы, например, воздух, кислород, азот, даже при обычных условиях (комнатная температуре и атмосферное давление) мало отличаются от идеального газа. Особенно близки по своим свойствам к идеальному газу гелий и водород.
Существует два основных подхода к изучению газов: с учетом их молекулярного строения и использования микропараметров (масса и скорость молекул, их концентрация и т. д.) и без учета молекулярного строения, когда газы описываются макропараметрами (давлением р, объемом V, температурой T, полной массой всех молекул газа М).
В рамках молекулярно-кинетической теории давление, производимое газом на стенки сосуда, возникает вследствие того, что молекулы газа, беспорядочно двигаясь, ударяются о стенки сосуда, передавая им при каждом соударении свой импульс. Суммарный импульс, переданный за единицу времени единице площади, — это и есть давление, производимое газом.
5. Максвелл
Скорости молекул газа
имеют различные значения и направления,
причем из-за огромного числа соударений,
которые ежесекундно испытывает молекула,
скорость ее постоянно изменяеться.
Поэтому нельзя определить число молекул,
которые обладают точно заданной скоростью
v в данный момент времени, но можно
подсчитать число молекул, скорости
которых имеют значение, лежащие между
некоторыми скоростями v1 и v2 . На основании
теории вероятности Максвелл установил
закономерность, по которой можно
определить число молекул газа, скорости
которых при данной температуре заключены
в некотором интервале скоростей. Согласно
распределению Максвелла, вероятное
число молекул в единице объема; компоненты
скоростей которых лежат в интервале от
![]() до
до![]() , от
, от![]() до
до![]() и
и![]() от до
от до
![]() , определяются функцией распределения
Максвелла
, определяются функцией распределения
Максвелла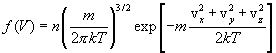
где m - масса молекулы, n - число молекул в единице объема. Отсюда следует, чтсг число молекул, абсолютные значения скоростей которых лежат в интервале от v до v + dv, имеет вид
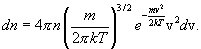

Распределение Максвелла
достигает максимума при скорости![]() , т.е. такой скорсти, к которой близки
скорости большинства молекул. Площадь
заштрихованной полоски с основанием
dV покажет, какая часть от общего числа
молекул имеет скорости, лежащие в данном
интервале. Конкретный вид функции
распределения Максвелла зависит от
рода газа (массы молекулы) и температуры.
Давление и объем газа на распределение
молекул по скоростям не влияет.
, т.е. такой скорсти, к которой близки
скорости большинства молекул. Площадь
заштрихованной полоски с основанием
dV покажет, какая часть от общего числа
молекул имеет скорости, лежащие в данном
интервале. Конкретный вид функции
распределения Максвелла зависит от
рода газа (массы молекулы) и температуры.
Давление и объем газа на распределение
молекул по скоростям не влияет.
Кривая распределения Максвелла позволит найти среднюю арифметическую скорость
![]()
Таким образо:![]()
С Повышением температуры наиболее вероятная скорость возрастает, поэтому максимум распределения молекул по скоростям сдвигается в сторону больших скоростей, а его абсолютная величина уменьшается. Следовательно, при нагревании газа доля молекул, обладающих малыми скоростями уменьшается, а доля молекул с большими скоростями увеличивается.
6 Уравнение состояние идеального газа
Соотношение p = nkT,
связывающее давление газа с его
температурой и концентрацией молекул,
получено для модели идеального газа,
молекулы которого взаимодействуют
между собой и со стенками сосуда только
во время упругих столкновений. Это
соотношение может быть записано в другой
форме, устанавливающей связь между
макроскопическими параметрами газа –
объемом V, давлением p, температурой T и
количеством вещества ν. Для этого нужно
использовать равенства
![]()
Здесь N – число молекул
в сосуде, NА – постоянная Авогадро, m –
масса газа в сосуде, M – молярная масса
газа. В итоге получим:
![]()
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть: R = 8,31 Дж/моль·К.
Соотношение![]() называется уравнением состояния
идеального газа.
называется уравнением состояния
идеального газа.
Для одного моля любого газа это соотношение принимает вид: pV=RT
Если температура газа равна Tн = 273,15 К (0 °С), а давление pн = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный V0 = 0,0224 м3/моль = 22,4 дм3/моль
