- •1 Вопрос Причины появления естественных наук. Открытие различных цивилизаций, которые способствовали появлению естественных наук.
- •2 Вопрос История Физики.
- •5 Вопрос Связь физики с техникой и другими науками.
- •6 Вопрос Небесная сфера, созвездие.
- •7 Вопрос Гипотеза происхождения Солнечной системы
- •8 Вопрос
- •9 Вопрос Законы сохранения. Силы в природе.
- •10 Вопрос Молекулярно-кинетическая теория (мкт).
- •11 Вопрос Характеристики молекул.
- •12 Вопрос Опыты доказывающие основные положения молекулярно кинетической теории.
- •13 Вопрос Диффузия. Опыт Штерна.
- •14 Вопрос Силы взаимодействия молекул. Графики зависимости сил и потенциальной энергии, взаимодействие молекул от расстояния между молекулами.
- •15 Вопрос Идеальный газ – молекулы которого являются не взаимодействующими материальными точками.
- •18 Вопрос Термодинамика. Понятия внутренней энергии. 1 Закон термодинамики
- •19 Вопрос Второй закон термодинамики.
- •20 Вопрос Агрегатные состояния вещества.
- •21 Вопрос Влажность воздуха.
- •22 Вопрос Парообразование и Конденсация
- •23 Вопрос Свойства жидкости
- •26 Вопрос Тепловое расширение тел.
- •27 Вопрос Электрическое поле. Заряд. Закон сохранения заряда. Электризация.
- •28 Вопрос Взаимодействие заряда. Закон Кулона.
- •29 Вопрос Силовая характеристика электрического поля – напряженность.
- •30 Вопрос Графическое изображение электрических полей. Линии напряженности.
- •31 Вопрос Работа электрического поля по перемещению заряда.
- •32 Вопрос Проводники и диэлектрики в электрическом поле.
- •33 Вопрос Электрическая емкость проводника. Конденсаторы.
- •36 Вопрос Условия возникновения тока. Внешний и внутренний участки цепи. Эдс. Закон Ома для полной цепи (1 форма).
- •37 Вопрос Закон Ома для участка цепи. Сопротивление проводника.
- •40 Вопрос Работа, мощность и тепловое действие тока.
- •1 Билет Термоэлектронная эмиссия и ее применение.
- •2 Билет Прямое и обратное термоэлектрическое явление.
- •3 Билет Электрический ток в различных средах. Электрический ток в электролитах.
- •4 Билет Электрический ток в газах.
- •7 Билет
- •8 Билет Магнитное поле.
- •9 Билет Изображение магнитных полей, линии индукции и их свойства.
- •10 Билет Сила Ампера
- •11 Билет Сила Лоренца
- •12 Билет Магнитные свойства веществ.
- •13 Билет Электромагнитная индукция. Опыты Фарадея.
- •14 Билет Правило Ленца.
- •15 Билет Частные случаи явления электромагнитной индукции. Самоиндукция. Вихревые токи.
- •16 Билет Колебания. Условия возникновения колебаний. Виды колебаний.
- •17 Билет Резонанс. Волны.
- •18 Билет Интерференция и дифракция волн.
- •19 Билет Возникновение электромагнитных колебаний в колебательном контуре.
- •20 Билет Затухающие электромагнитные колебания. Генератор незатухающих электромагнитных колебаний.
- •21 Билет Электромагнитные волны. История открытия радиосвязи.
- •22 Билет Открытие радиосвязи а. С. Поповым.
- •I . _ в к.К. I . _ (после т. К.)
- •I . _ (в т.) I . _ (после детектора)
- •26 Билет Фотометрия.
- •27 Билет Световые явления на границе раздела двух сред. Законы отражения.
- •28 Билет Законы преломления.
- •29 Билет Интерференция света
- •30 Билет Дифракция света
- •31 Билет Дисперсия света
- •32 Билет Виды спектров, спектральный анализ .
- •33 Билет Шкала электромагнитных волн.
- •34 Билет Фотоэффект и его виды.
- •Билет 35 Давление света. Химическое действие света
- •37 Билет Физика атома и атомного ядра. История развития представлений о строении атома.
- •38 Билет Модель атома Бора.
- •39 Билет Радиоактивность.
- •40 Билет Состав атомных ядер.
- •41 Билет Энергии связи атомных ядер.
- •Билет 46. Строение Вселенной.
15 Вопрос Идеальный газ – молекулы которого являются не взаимодействующими материальными точками.
Идеальный газ это физическая модель.
Fвзаим = 0 Vмол = 0
Вакуум – это разряженный газ
Применения вакуума:
- Электро лучевая трубка (кинеском)
-Ускоритель элементарных частиц (микрофазатрон)
3. Термодинамические параметры газа – это величины однозначно характеризующие состояние газа P,V,T (давление, объем, температура)
а) Давление Р
P=⅔n0 пост
- основное
уравнение МКТ. (
пост
- Средняя
кенетическая энергия поступательного
движения молекул.)
пост
- основное
уравнение МКТ. (
пост
- Средняя
кенетическая энергия поступательного
движения молекул.)
Измеряется манометрами, барометрами.
[P] = 1 Па
б) Температура Т
пост= кТ
(К – постоянная Больцмана)
кТ
(К – постоянная Больцмана)
Температура – это мера средней кенетической энергии поступательного движения молекул.
[T] = 1K
T = tC + 273o
(Понятие температуры пременимо только к телам и не может применятся к одной молекуле).
в) Объем V
Vгаза = Vсосуда
[V] = 1м3
16 Вопрос
Вывод уравнения Менделеева-Клаперона. Объедененый газовый закон.
Выведем уравнение, которое связывет 3 динамические параметра: P,V,T.



 – уравнение
состояния идеального газа или уравнение
Менделеева-Клаперона
– уравнение
состояния идеального газа или уравнение
Менделеева-Клаперона
R – молярная газовая постоянная.
2)
Пусть m
= const
 = const
= const




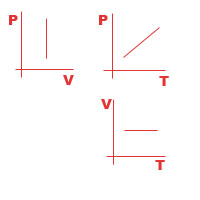
17 Вопрос
Изопроцессы в газах.
Изопроцессами в газах называются такие процессы, в которых не изменяется один из термодинамических параметров.
m = const M = const |
||||
V = const Изохорный процесс
Закон Шарля
|
P = const Изобарный процесс
Закон Гей
Люссона
|
T = const Изотермический процесс
PV = const Закон Бойля Мариотта
|
||
Работа газа |
||||
А = 0 |
А = P∙ΔV |
A = S |
||
Физичиский смысл молярной газовой постоянной.
Расчитаем работу 1 моля газа при изобарном нагревании
А1моль
= P∙ΔV
=
 R∙ΔT
= RΔT
R∙ΔT
= RΔT
A1моль = R∙ΔT
R
=

Молярная газовая постоянная численно равна работе одного моля газа при изобарном нагревании на 1 Кельвин.
18 Вопрос Термодинамика. Понятия внутренней энергии. 1 Закон термодинамики
Термодинамика – это часть физики, которая рассматривает тепловые процессы, происходящие с теплом, а так же превращение энергии соответствующее данным процессам.
Внутреннея энергия тела – это величина численно равная сумме:
кинетических энергий частиц, из которых состоит тело,
потонцеальных энергий частиц,
ядерных энергий частиц,
энергии электронов.
Из определения видно, что рассчитать внутреннею энергию тела очень трудно, практически невозможно.
Просто считается лишь внутренняя энергия идеального газа
 (для одноатомного
газа)
(для одноатомного
газа)
Для тела можно сосчитать изменения внутренней энергии (ΔU), зная два способа изменения внутренней энергии:
Теплообмен (Q)
Механической работой (Амех.)
Q = ΔV + Aмех (для изобарного процесса)
Первый закон термодинамики (для изобарного процесса)
Он представляет собой частный случай закона сохранения энергии для тепловых и механических процессов.
Количество теплоты переданное телу или системе тел идет на увиличение внутренней энергии тела или системы тел и на совершение телом или системой тел механической работы.
+Q - количество теплоты сообщается телу или системе тел
-Q – количество теплоты отнимается телу или системе тел
+ΔU – внутренняя энергия увиличивается
-ΔU –внутренняя энергия уменьшается
+Амех. – работа совершается телом или газом.
-Амех. – работа совершается над телом или газом
Частные случаи первого закона термодинамики.
Q = 0 -ΔU = Амех. Адиабатный процесс. Процесс идущий без теплообмена с окружающей средой |
ΔU = 0 Q = Амех. Изотермический процесс |
Амех. = 0 Q = ΔU Изохорный процесс |