
- •Фотоэффект
- •Формула Резерфорда
- •Экспериментальные закономерности линейчатых спектров
- •Волновые свойства частиц
- •Уравнение Шредингера
- •Ортогональность собственных функций
- •Представление физических величин посредством операторов
- •Одномерная потенциальная яма
- •Квантовогармонический осциллятор
- •Мультиплетность спектров и спин электрона
- •Результирующий момент многоэлектронного атома
- •Распределение электронов в атоме по энергетическим уровням
- •Периодическая система элементов
- •Рентгеновский спектр
Мультиплетность спектров и спин электрона
У щёлочных металлов расщепление линий
перехода
![]() различно,
а
различно,
а
![]() – одинаково.
– одинаково.
Мультиплетность – расщепление линий на несколько компонент.
Собственный момент импульса электрона называется спином.
Квантовое число, соответствующее спину
– s. Для электрона
![]() .
Тогда спин электрона
.
Тогда спин электрона
![]() .
Проекция спина на ось z
.
Проекция спина на ось z
![]() ,
где
,
где
![]() для электрона. Отношение магнитного
момента к механическому для электрона:
для электрона. Отношение магнитного
момента к механическому для электрона:
![]()
![]() .
Знак «–» означает, что
.
Знак «–» означает, что
![]() .
.
![]() .
.
Если в атоме один валентный электрон
(атом щелочного металла), то полный
магнитный момент
![]() ,
где
,
где
![]() через 1. Для одного электрона
через 1. Для одного электрона
![]() .
Из-за того, что для уровней, у которых
.
Из-за того, что для уровней, у которых
![]() полный магнитный момент
полный магнитный момент
![]() может принимать два значения, то и
магнитный момент будет иметь два значения
и состояния с различными значениями j
будут обладать различной энергией.
может принимать два значения, то и
магнитный момент будет иметь два значения
и состояния с различными значениями j
будут обладать различной энергией.
Взаимодействие магнитных моментов электрона и атома называется спин-орбитальным взаимодействием. Им объясняется расщепление линий на две компоненты.
Правило отбора:
![]() .
.
Т ерм
– местонахождение атома среди его
энергетических уровней.
ерм
– местонахождение атома среди его
энергетических уровней.
Обозначение:
![]() .
.
Результирующий момент многоэлектронного атома
Путём сложения всех моментов электрона,
как собственных, так и орбитальных,
возникает полный механический момент
атома. Он получается двумя способами:
если в атоме присутствует связь
Ресселя-Сандерса, то взаимодействие
собственных магнитных моментов и
взаимодействие орбитальных моментов
электронов сильнее, чем взаимодействие
собственных и орбитальных моментов
электронов. Тогда
![]() ,
где N – число электронов,
,
где N – число электронов,
![]() и
и
![]() – соответственно орбитальный и
собственный моменты i-го
электрона. Иначе в атоме присутствует
j-j-связь.
Тогда
– соответственно орбитальный и
собственный моменты i-го
электрона. Иначе в атоме присутствует
j-j-связь.
Тогда
![]() .
Эта связь встречается реже и свойственна
тяжёлым атомам.
.
Эта связь встречается реже и свойственна
тяжёлым атомам.
Можно представить
![]() так:
так:
![]() ,
где g – фактор Ланде,
зависящей от L и S.
,
где g – фактор Ланде,
зависящей от L и S.
С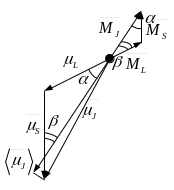 реднее
по времени значение полного магнитного
момента
реднее
по времени значение полного магнитного
момента
![]() .
При этом
.
При этом
![]()
![]() .
Аналогично
.
Аналогично
![]() .
Тогда
.
Тогда
![]()
![]()
![]() .
.
Распределение электронов в атоме по энергетическим уровням
Принцип Паули: В одной и той же квантовой системе не может быть двух частиц с полуцелым спином, обладающих одним и тем же набором квантовых чисел.
Состояние электронов в атоме характеризуется
числами:
![]() .
.
Основным состоянием атома является такое, которое обладает минимальной энергией.
Вырождение по числу
![]() для электрона равно
для электрона равно
![]() .
При
.
При
![]() – 2 электрона,
– 2 электрона,
![]() .
.
Совокупность электронов, характеризующихся одинаковым главным квантовым числом, называется слоем.
Совокупность электронов, характеризующихся одинаковым орбитальным квантовым числом, называется оболочкой.
Иногда слои называют оболочками, а оболочки – подоболочками.
Слой |
Оболочка |
n |
l |
|
|
К |
|
1 |
0 |
0 |
|
L |
2S |
2 |
0 |
0 |
|
2P |
1 |
–1 |
|
||
0 |
|
||||
1 |
|
||||
M |
3S |
3 |
0 |
0 |
|
3P |
1 |
–1 |
|
||
0 |
|
||||
1 |
|
||||
3D |
2 |
–2 |
|
||
–1 |
|
||||
0 |
|
||||
1 |
|
||||
2 |
|
Для полностью заполненной оболочки суммарный орбитальный момент равен 0 и суммарный спиновой момент равен 0, следовательно, и полный механический момент равен 0.
