
- •Билет №1
- •Билет №2
- •Физ свва
- •400 Кг/м³ (жидкий).
- •Билет №3
- •Билет №4
- •Билет№5
- •Основные промышленные группы 0%9f%d0%be%d0%bb%d0%b8%d0%bc%d0%b5%d1%80"полимеров, синтезируемых поликонденсацией
- •Билет №6
- •Билет №7
- •Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
- •Химические свойства
- •Химические свойства металлов
- •Билет №8
- •Физические свойства
- •Применение
Физ свва
Ориентировочные физические характеристики (зависят от состава; при нормальных условиях, если не указано другое):
Плотность:
от 0,68 до 0,85 кг/м³ относительно воздуха (сухой газообразный);
400 Кг/м³ (жидкий).
Температура самовозгорания: 650 °C;
Взрывоопасные концентрации смеси газа с воздухом от 5 % до 15 % объёмных;
Удельная теплота сгорания: 28—46 М0%94%D0%B6%D0%BE%D1%83%D0%BB%D1%8C"Дж/м³ (6,7—11,0 М0%9A%D0%B0%D0%BB%D0%BE%D1%80%D0%B8%D1%8F"кал/м³)0%9F%D1%80%D0%B8%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7"[1];
Октановое число при использовании в двигателях внутреннего сгорания: 120—130.
Легче воздуха в 1,8 раз, поэтому при утечке не собирается в низинах, а поднимается вверх0%9F%D1%80%D0%B8%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7"[2].
Применение
Природный газ широко применяется в качестве горючего в жилых, частных и многоквартирных домах для отопления, подогрева воды и приготовления пищи; как0%A2%D0%BE%D0%BF%D0%BB%D0%B8%D0%B2%D0%BE"топливо для 0%90%D0%B2%D1%82%D0%BE%D0%BC%D0%BE%D0%B1%D0%B8%D0%BB%D1%8C"машин (газотопливная система автомобиля), 0%9A%D0%BE%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F"котельных, 0%A2%D0%AD%D0%A6"ТЭЦ и др. Сейчас он используется в химической промышленности как исходное сырьё для получения различных органических веществ, например, пластмасс. В 0%B2%D0%B5%D0%BA"XIX веке природный газ использовался в первых 0%A1%D0%B2%D0%B5%D1%82%D0%BE%D1%84%D0%BE%D1%80"светофорах и для освещения (применялись 0%93%D0%B0%D0%B7%D0%BE%D0%B2%D0%B0%D1%8F_%D0%BB%D0%B0%D0%BC%D0%BF%D0%B0"газовые лампы)
3
Приготовление суспензии карбоната кальция в воде
Налить в 2 пробирки по 5мл дистиллированной воды. В пробирку №1 добавить 1мл 0,5%-ного раствора желатина. Затем в обе пробирки внести небольшое количество мела и сильно взболтать.
Поставить обе пробирки в штатив и наблюдать расслаивание суспензии. Одинаково ли время расслаивания в обеих пробирках? Какую роль играет желатин? Что является в данной суспензии дисперсной фазой и дисперсионной средой?
Билет №3
1
Ковалентная связь образуется за счет перекрывания электронных облаков двух атомов. Каждый атом предоставляет один неспаренный электрон для образования одной химической связи, при этом происходит образование общей электронной пары. Если ковалентная связь образуется между двумя одинаковыми атомами, она называется неполярной.

Если ковалентная связь образуется между двумя различными атомами, общая электронная пара смещайся к атому с большей электроотрицательностью (электроотрицательностью называется способность атома притягивать электроны). В этом случае возникает полярная ковалентная связь.
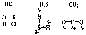
Частным случаем ковалентной связи является донорно-акцепторная связь. Для ее образованья у одного атома должна быть свободная орбиталь на внешнем электронном уровне, а у другого — пара электронов. Один атом (донор) предоставляет другому (акцептору) свою электронную пару, в результате она становится общей, образуется химическая связь. Пример — молекула СО:
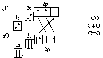
Ионная связь образуется между атомами с сильно отличающейся электроотрицательностью. При этом один атом отдает электроны и превращается в положительно заряженный ион, а атом, получивший электроны, в отрицательно заряженный. Ионы удерживаются вместе за счет сил электростатического притяжения.
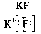
Водородная связь образуется между полярными молекулами (вода, спирты, аммиак) за счет притяжения разноименных зарядов.

Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи.
2
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные0%A3%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D1%8B"углеводороды, содержащие одну 0%94%D0%B2%D0%BE%D0%B9%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C_(%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)&action=edit&redlink=1"двойную связь между атомами 0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4"углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют 0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D1%8B%D0%B9_%D1%83%D0%B3%D0%BE%D0%BB"валентный угол 120°. Простейшим алкеном является 0%AD%D1%82%D0%B8%D0%BB%D0%B5%D0%BD"этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил».
Этиле́н (по 0%98%D0%AE%D0%9F%D0%90%D0%9A"ИЮПАК: этен) — 0%9E%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F"органическое 0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5"химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях - бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным 0%A3%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"углеводородам. Играет чрезвычайно важную роль в промышленности, а также является 0%A4%D0%B8%D1%82%D0%BE%D0%B3%D0%BE%D1%80%D0%BC%D0%BE%D0%BD"фитогормоном. Этилен — самое производимое органическое соединение в мире0%AD%D1%82%D0%B8%D0%BB%D0%B5%D0%BD"[1]; общее мировое производство этилена в 0%B3%D0%BE%D0%B4"2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год0%AD%D1%82%D0%B8%D0%BB%D0%B5%D0%BD"[2]. 0%9D%D0%B0%D1%80%D0%BA%D0%BE%D1%82%D0%B8%D0%BA"Наркотик. Класс опасности - четвёртый
3
Разбавленные кислоты реагируют с металлами, стоящими слева от водорода в ряду напряжения металлов с образованием соли и водорода, например, при взаимодействии серной кислоты с цинком образуются сульфат цинка и водород:
Zn + H2SO4 = ZnSO4 + H2
Растворы кислот взаимодействуют с основными оксидами с образованием соли и воды, например, при взаимодействии серной кислоты с оксидом меди(II) образуются сульфат меди(II) и вода:
H2SO4 + CuO = CuSO4 + H2O
Все кислоты взаимодействуют с основаниями с образованием соли и воды, например: при взаимодействии серной кислоты с гидроксидом натрия образуются сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
2OH- + 2H+ = 2H2O.
Гидроксид меди(II) растворяется в серной кислоте с образованием сульфата меди(II) и воды:
Cu(OH)2 + H2SO4 = Cu SO4 + 2H2O
Cu(OH)2 + 2H+ + SO42- = Cu2+ + SO42- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
Кислоты вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок или выделяется газ), например: при взаимодействии серной кислоты с раствором силиката натрия образуется осадок кремниевой кислоты.
H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4
Реакция протекает за счёт связывания катионов водорода с силикат-ионами.
При взаимодействии соляной кислоты с раствором карбоната натрия выделяется углекислый газ и образуется вода:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
Реакция протекает за счёт связывания катионов водорода и карбонат-ионов.
