
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
29.Условия самопроизвольного протекания химических реакций.
В химических системах вещества стремятся к минимуму внутренней энергии. Экзотермические реакции протекают самопроизвольно, так как вещества при их окончании достигают свой минимум внутренней энергии. Но также самопроизвольно протекают и эндотермические реакции - это растворение солей.Макросостояние системы тем более вероятно, чем большим числом микросостояний оно может быть описано.Условия самопроизвольного протекания реакций: 1. стремление системы к достижению минимального значения внутренней энергии 2. стремление системы к более вероятному своему состоянию.Но часто происходит столкновение этих двух определяющих факторов , и возникает состояние называемое химическим равновесием. Функция, которая учитывает оба этих фактора – энергия Гиббса.Самопроизвольно протекают те процессы , энергия Гиббса которых равна отрицательному значению.Если температура мала , то энтальпия равна энергии Гиббса и самопроизвольно протекают экзотермические реакции.Если высокая температура , то отрицательное значение имеет энергия Гиббса и реакции протекают самопроизвольно. Необратимые реакции протекают до полного израсходования одного из реагентов. Обратимые протекают во взаимопротивоположных направлениях .В состоянии химического равновесия система достигает своего минимального значения энергии и энергия Гиббса, как и константа химического равновесия, равна нулю.
31.
Константа
химического равновесия. Расчет Кр, Кс,
КмРассмотрим
гомогенную хим.р-ю: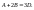 Р-и протекают до полного исчезновения
исходных в-в, а останавливаются при
достижении определенного сост.равн-я.
Условия хим.равновесия:
Р-и протекают до полного исчезновения
исходных в-в, а останавливаются при
достижении определенного сост.равн-я.
Условия хим.равновесия:
 Равновесные
давления участников реакции:
Равновесные
давления участников реакции:
 Согласно закону действ. масс
Согласно закону действ. масс

 конст.равн-я,
выраженная через парц.давл-я.
Размерность
конст.равн-я,
выраженная через парц.давл-я.
Размерность

 изм-е числа молей при протекании р-и.При
написании конст.равновесия гетерогенных
реакции учитываются парциальные давления
только газообразных участников р-й,
поскольку давления пара конденсированных
фаз малы по сравнению с газообразными
компонентами. Пример.
изм-е числа молей при протекании р-и.При
написании конст.равновесия гетерогенных
реакции учитываются парциальные давления
только газообразных участников р-й,
поскольку давления пара конденсированных
фаз малы по сравнению с газообразными
компонентами. Пример.


 конст.равн-я,
выраженная через концентрации.
конст.равн-я,
выраженная через концентрации. еще
еще Соотн-я
м/у конст-ми равновесия:
Соотн-я
м/у конст-ми равновесия:


33.Принцип
Ле-Шателье.При
неизменных условиях химическое равновесие
в системе может сохраняться сколь угодно
долго. В случае же изменения условий
(концентрация, температура, давление)
одна из противоположно направленных
реакций может ускориться, чем другая.
После этого равновесие сместится, и
установится новое состояние
равновесия.Принцип
Ле-Шателье: если
на систему, находящуюся в истинном
химическом равновесии, оказывают
воздействие извне путем изменения
какого-либо из условий, определяющих
положение равновесия, то оно смещается
в направлении той реакции, протекание
которой ослабляет эффект произведенного
воздействия.1.
Влияние температуры.Повышение
температуры смещает равновесие в сторону
процесса, идущего с поглощением тепла.
 2.
Влияние концентрации.При
увеличении концентрации исходных
веществ равновесие смещается в сторону
реакции, потребляющей эти вещества
(вправо).
2.
Влияние концентрации.При
увеличении концентрации исходных
веществ равновесие смещается в сторону
реакции, потребляющей эти вещества
(вправо). 3.
Влияние давления.Увеличение
давления смещает равновесие в сторону
меньшего числа молей, т.е. в сторону
падения давления.Примечание. На реакцию,
идущую без изменения числа молей,
давление не влияет.
3.
Влияние давления.Увеличение
давления смещает равновесие в сторону
меньшего числа молей, т.е. в сторону
падения давления.Примечание. На реакцию,
идущую без изменения числа молей,
давление не влияет.

