
21.Электрохимические методы анализа, совокупность методов качественного и количественного анализа, основанных на электрохимических явлениях, происходящих в исследуемой среде или на границе раздела фаз и связанных с изменением структуры, химического состава или концентрации анализируемого вещества.
Классификация:
По природе источника электрической энергии
А) без наложения внешнего потенциала (электролиз) к ним относят потенциометрические методы, в которых источником электрической энергии служит сама электрохимическая система, которая является гальваническим элементом. ЭДС и электродные потенциалы зависят от содержания определенного вещества в системе.
Б) с наложением внешнего потенциала, к ним относят :
Кондуктометрический анализ, основанный на измерении электропроводимости раствора, как ф-ии концентрации определенного в-ва
Вольтамперометрический метод основан на измерении силы тока, как ф-ии разности потенциалов и концентраций раствора
Кулонометрический анализ основан на измерении кол-ва электричества, которое зависит от концентрации раствора
Электрогравиметрический анализ основан на измерении массы продукта электрохимической реакции
2. По способу применения:
А) прямые измеряют электрохимический параметр, как ф-ю концентрации раствора
Б) косвенные – все методы титрования, т.е. титрование фиксируют на основании измерения электрических параметров системы:
Потенцометрия прямая – рН-метр
Потенциометрическое титрование
Потенциометрия – это метод для изучения физико-химических свойств, по средствам измерения ЭДС обратимых ГЭ. Используется для определения рН и концентрации растворов. В основе потенциометрии лежит фомула Нерста:
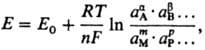 aА
+ bВ + ... + nе
aА
+ bВ + ... + nе
![]() mМ + рP
mМ + рP
где Е0 стандартный потенциал, R-газовая постоянная, Т-абс. т-ра, F-постоянная Фарадея, n-число электронов, участвующих в р-ции, a, b, ..., т, р ...-стехиометрич. коэф. при компонентах р-ции А, В, ..., М, Р (к-рыми м.б. ионы и молекулы в жидкой, твердой или газовой фазе). Активности твердых и газообразных компонентов и р-рителей принимают за единицу.
В электрохимической ячейке 2 электрода: индикаторный электрод и электрод сравнения. Потенциал индикаторного электрода зависит от концентрации в-ва в анализируемом растворе. Потенциал электрода сравнения в условиях анализа не меняется.
В потенциометрии используют электрода 1 рода, 2 рода, окислительно-восстановительные электроды и мембранные электроды.
Электроды 1 рода – это электроды обратимые по катиону общему с Met. 3 вида:
Met погружен в соль того же Met : φрметп+/мет= φ0метп+/мет + (0,059/n)×lg[Mn+]
Газовые электроды (водородный): φр2H+/H2 = - 0,059рН = 0,059lg a(H3O+)
Амальгамные электроды – это амальгама, погруженная в раствор, содержащий катионы того же Met: φр = φ0 + (RT/nF)×lg a(Mn+)/a(M)-амальгама
Эти электроды обладают высокой обратимостью.
Электрода 2 рода – обратимы по аниону, в этом случае электрод может быть сделанным из met и покрытым сверху малорастворимой солью этого же металла.
Хлорсеребряный Ag/AgCl, KCl;
Каломельный Hg/Hg2Cl2.
φрА-/А= φ0А-/А-0,059/n*lgaA-
Эти электроды стабильны в работе, часто используются в качестве электродов сравнения, способны устойчиво поддерживать постоянное значение потенциала.
Газовые электроды 2 рода (хлорный) Pt, Cl2 / KCl применяются редко.
Окислительно-восстановительные электроды состоят из инертного материала (Pt,C,Au), погружаются в раствор содерж окислительную и восстановительную форму данного в-ва.
2 вида: 1) электроды потенциал, которых не зависит от активности ионов Н.
2) электроды потенциал, которых зависит от активности Н.
Pt| FeCl3/FeCl2
Pt|K3[Fe(CN)6] / K4[Fe(CN)6]
Хингидройдный электрод зависит от активности водорода φр=φ0+0,059/n *Lg[Ox]/[Red]
Если участвует ион Н, то активность ионов Н учитывается в уравнении Нерста.
Мембранные (ион-селективные) электроды – это электроды обратимые по тем или иным ионам, сорбируемым твердой или жидкой мембраной. Активность зависит от иона в р-ре, сорбируемого мембраной. По обе стороны мембраны нах-ся в разные растворы, содержащие одни и те же ионы, по разной концентрации. С одной стороны нах-ся стандартный раствор с неизвестной концентрацией, а с другой анализируемый, с неизвестной концентрацией. При этом возникает мембранная разность потенциалов.
Прямая потенциометрия: заключается в измерении ЭДС, возникающих при погружении рабочего электрода в р-р опред. Концентрации. Пределы определ. Концентрации нахлод.в интервале от нескольких моль/л до 10-6моль/л, 0,05мл-100мл.
1.Метод градуированного графика, строим график по эталонам растворов. Измеряют ЭДС и определяют по графику С.

2.метод добавок стандарта. В ячейку с концентрацией Сх вносится определенный Vx анализируемого раствора, измеряют ЭДС.
Добавляют небольшой Vст стандартного раствора с известной концентрацией Сст, измеряют ЭДС со станд. р-ром.
εx- εСТ= 0,059/n lg [lgNx-lgNСТ];Cx=CСТ*VСТ /(Vx+VСТ)*[10n∆ε/0,059 – (Vx/(Vx+VСТ))]-1
Nx=Cx*Vx/(Vx+Vcт), Nст=Cст*Vст/(Vx+Vст)
Потенциометрическое титрование, в нем исп-ся компенсационная схема. При этом само титрование основано на изменении концентрации во время титрования и соотв. изм. электродного потенциала. Компенсационный метод заключается в том, что разница потенциалов измеряется скользящим потенциалом, при полной компенсации, стрелка гальванометра уст-ся на нуле,т.е. отсутствие электрического тока.

2 2.КОНДУКТОМЕТРИЯ-
совокупность электро-хим. методов
анализа, основаных на
использовании зависимости между
электропроводностью х растворов
электролитов и их концентрацией.
Электропроводность делиться на удельную
и эквивалентную. Удельная: k=1/ρ,
ρ-сопротивление. Эквивалентная:
λ=(1000*К)/Сэ, Сэ-молярная концентрация
соответсв. эквивалента. μ=(1000*К)/См
В прямой К. используют расчетный метод
(непосредственно определяют концентрацию
электролита по х его р-ра (Сэ=1000К/
λ, См=1000К/ μ). Метод применяется гл.
обр. для анализа разб. р-ров.) и метод
градуировачных графиков (В случае
концентрир. р-ров). Определение в-в в
присут. других электролитов возможно,
если концентрации последних постоянны.
2.КОНДУКТОМЕТРИЯ-
совокупность электро-хим. методов
анализа, основаных на
использовании зависимости между
электропроводностью х растворов
электролитов и их концентрацией.
Электропроводность делиться на удельную
и эквивалентную. Удельная: k=1/ρ,
ρ-сопротивление. Эквивалентная:
λ=(1000*К)/Сэ, Сэ-молярная концентрация
соответсв. эквивалента. μ=(1000*К)/См
В прямой К. используют расчетный метод
(непосредственно определяют концентрацию
электролита по х его р-ра (Сэ=1000К/
λ, См=1000К/ μ). Метод применяется гл.
обр. для анализа разб. р-ров.) и метод
градуировачных графиков (В случае
концентрир. р-ров). Определение в-в в
присут. других электролитов возможно,
если концентрации последних постоянны.
Кондуктометрическое титрование (К. т.) основано на изменении х р-ра при хим. р-циях, связанном с изменением концентрации ионов разл. подвижности. К. т. проводят в водных, водно-орг. и неводных средах. Кривые титрования, представляющие собой зависимость х от кол-ва прибавленного реагента (титранта), имеют излом в точке эквивалентности. При титровании смесей электролитов число изломов равно числу определяемых компонентов, взаимодействующих с титрантом. Форма кривых м. б. разной (рис. 2). К. т. может быть основано на разл. р-циях. наиб. широко используются кислотно-основные взаимодействия. Так, разработаны методы определения в воде к-т и оснований. При титровании сильными основаниями сильных или слабых к-т х до точки эквивалентности соответственно понижается. При избытке сильного основания после точки эквивалентности ( резко увеличивается При титровании солей ( до точки эквивалентности сравнительно мало изменяется, т. к. подвижности заменяющих друг друга ионов близки. Поэтому возможен анализ смесей солей с к-тами или основаниями, содержащих от 2 до 5 компонентов.
К ривые
кондуктометрич. титрования в контактной
ячейке р-ром NaOH: 1 - соляной к-ты; 2 - CH3COOH;
3 - смеси HCl+СН 3 СООН+(C2H5)3N. НCl+фенол.
ривые
кондуктометрич. титрования в контактной
ячейке р-ром NaOH: 1 - соляной к-ты; 2 - CH3COOH;
3 - смеси HCl+СН 3 СООН+(C2H5)3N. НCl+фенол.
Достоинства К.: высокая чувствительность (ниж. граница определяемых концентраций ~10-4-10-5 М), достаточно высокая точность (относит, погрешность определения 0,1-2%), простота методик, доступность аппаратуры, возможность исследования окрашенных и мутных р-ров, а также автоматизации анализа. Различают 2 вида: прямая кондуктометрия и кондуктометрическое титрование.
Полярография, электрохимический метод анализа, основанный на определении диффузионного эл.тока с концентрацией опред.в-ва. Основана на расшифровке вольтамперных кривых — полярограмм — получаемых при электролизе исследуемых растворов и выражающих зависимость силы тока I от приложенного к электролитической ячейке постоянного (по форме) напряжения Епост. Для получения полярограмм (регистрируются с помощью полярографов) исследуемый раствор помещают в ячейку с микрокатодом (МК) и макроанодом (МА), подключенные к внеш.источ. пост. Эл. Тока. На МК прилагается постепенно возрастающий по абсолютной величине отрицательный электрический потенциал. В качестве МК чаще всего используют ртутно-капающий электрод (его поверхность обновляется). В качестве МА: жидкая ртуть на дне сосуда, чаще применяют насыщенный каломельный электрод. При постепенном увеличении приложенного потенциала вначале Эл.ток остается почти постоянным- это остаточный ток. При некотором значении потенциала, назыв. Потенциалом выделения,ток в ячейке резко возрастает и при незначит. Увеличении потенциала происходит скачок силы тока и он достигает max значения. Этот ток назыв. Предельным. Разность м/у пред. И остат. Током – диффузионный ток. В П. используют процессы окисления — восстановления, адсорбции, катализа.
![]()
 Ур-е
Ильковича: id=kc;
Iпред=knFCD0,5V2/3t1/6
, где k-коэф. Пропорциональности,
n- число электронов,учавств.
в реакц. Восстановления., F-число
фарадея, С- концентрация деполяризатора(опред.
в-ва), D-коэф.дифузии
реагирующих в-в, V-скорость
вытекания ртути из капилляра, t-время
жизни капли. концентрацию в-ва находят
на основе предельного значения тока в
процессе электролиза раствора. Здесь
устанавливается пропорциональность
между величиной диффузионного эл.тока
и концентрацией опред.в-ва. ДОС-ва:
высокая чувствительность 10-5-10-6моль/л,
высокая селективность, хорошая
воспроизводимость результатов, широкий
диапозон применения. Нед-ки: легкая
окисляемость ртути, токсичность.
Ур-е
Ильковича: id=kc;
Iпред=knFCD0,5V2/3t1/6
, где k-коэф. Пропорциональности,
n- число электронов,учавств.
в реакц. Восстановления., F-число
фарадея, С- концентрация деполяризатора(опред.
в-ва), D-коэф.дифузии
реагирующих в-в, V-скорость
вытекания ртути из капилляра, t-время
жизни капли. концентрацию в-ва находят
на основе предельного значения тока в
процессе электролиза раствора. Здесь
устанавливается пропорциональность
между величиной диффузионного эл.тока
и концентрацией опред.в-ва. ДОС-ва:
высокая чувствительность 10-5-10-6моль/л,
высокая селективность, хорошая
воспроизводимость результатов, широкий
диапозон применения. Нед-ки: легкая
окисляемость ртути, токсичность.
