
- •1.Предмет и задачи тд. Модели тд.
- •2.Модели тд. Объяснение агрегатных состояний вещества.
- •3.Методы тд.
- •4.Исходные понятия тд.
- •5.Постулаты термодинамики.
- •6.Начала тд.
- •7.Термическое и калорическое уравнения состояния. Термическое уравнение состояние идеального газа.
- •8.Внутренняя энергия идеального газа. Калорическое уравнение состояние идеального газа.
- •9.I начало термодинамики.
- •I начало тд обобщает закон сохранения энергии для тд процессов: количество теплоты, сообщаемое системе, идет на изменение ее внутренней энергии и совершение системой работы.
- •10.Теплоемкость.
- •11.Теплоемкость идеального газа.
- •12. 13.Теорема о равнораспределении энергии по степеням свободы. Число степеней свободы молекул. Число степеней свободы молекул. Выражение для внутренней энергии идеального газа.
- •14.Изохорический процесс: уравнение, график в pv, pt, vt координатах.
- •15.I начало термодинамики в изохорическом процессе.
- •16.Изобарический процесс: уравнение, график в pv, pt, vt координатах.
- •17. I начало термодинамики в изобарическом процессе.
- •18.Изотермический процесс: уравнение, график в pv, pt, vt координатах.
- •19.I начало термодинамики в изотермическом процессе.
- •20.Адиабатический процесс. Уравнение адиабаты. График адиабаты.
- •21.I начало термодинамики в адиабатическом процессе.
- •22.Политропный процесс. Уравнение политропы, показатель политропы, график политропы.
- •23.I начало термодинамики в политропном процессе.
- •24.Изопроцессы как предельные случаи политропного процесса.
- •25.Обратимые и циклические процессы.
- •26. Тепловые машины. Эффективность работы тепловой машины.
- •27.Холодильные машины. Эффективность работы холодильной машины.
- •28.29.Цикл Карно. К.П.Д. Цикла Карно. Идеальная тепловая машина Карно.
- •30. I Теорема Карно.
- •31.II теорема Карно. Реальные тепловые машины.
- •32.II начало термодинамики в формулировках Кельвина и Клаузиуса.
- •33.Тождество Клаузиуса, неравенство Клаузиуса.
- •34. Понятие энтропии. Свойства энтропии. Размерность.
- •35.Энтропия в обратимых и необратимых процессах.
- •36. Энтропия идеального газа.
- •37.III начало тд. Следствия III начала тд.
- •38.Энтальпия.
- •39.Свободная энергия идеального газа.
- •40.Метод тд потенциалов.
- •С 41 по 46 не разделила!смотреть тут(то что красным)!!!:
- •48.Условия равновесия и устойчивости системы в термостате при постоянном объеме.
- •49.Условия равновесия и устойчивости системы в термостате при постоянном внешнем давлении.
- •50.Условия равновесия и устойчивости системы при постоянных энтропии и давлении.
- •51. Условия равновесия и устойчивости системы при постоянных энтропии и объеме.
- •52.Условия равновесия и устойчивости системы с переменным числом частиц в термостате, при постоянных химическом потенциале и объеме.
- •53. Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
- •54.Принцип Ле Шателье-Брауна. Примеры проявления принципа Ле Шателье-Брауна.
- •55.Начала статистической физики: исходные понятия теории вероятности.
- •56.Начала статистической физики: макро- и микросостояния, статистический ансамбль, микроканонический ансамбль, постулат равновероятности.
- •57.Начала статистической физики: эргодическая гипотеза, статистический вес, статистическое толкование энтропии.
- •58.Начала статистической физики: флуктуации.
- •65.Характерные скорости распределения Максвелла: средняя квадратичная скорость.
- •66.Характерные скорости распределения Максвелла: наиболее вероятная скорость.
- •67. Подсчет числа молекул скорости, которых лежат в заданном диапазоне.
- •68.Экспериментальная проверка закона распределения.
- •69.Вывод основного уравнения молекулярно-кинетической теории идеального газа.
- •70.Вывод уравнения состояния. Закон Дальтона. Закон Авогадро.
- •71.72.( Не разделены!)Распределение Больцмана. (72)Барометрическая формула.
- •73.Экспериментальное определение постоянной Авогадро.
- •74.Теорема о равнораспределении энергии по степеням свободы.
- •75.Расхождение теории теплоемкости идеального газа с экспериментом.
- •76.Статистика Ферми-Дирака (подсчет числа микросостояний, функция распределения).
- •77.Статистика Бозе-Эйнштейна (подсчет числа микросостояний, функция распределения).
- •78.Длина свободного пробега.
- •79.Частота столкновений в единицу времени, понятие физического вакуума.
- •80.Явления переноса: теплопроводность.
- •81.Явления переноса: диффузия.
- •82.Явления переноса: вязкое трение.
- •83.Молекулярная теория явлений переноса: вывод уравнения переноса параметра .
- •84.Молекулярная теория явлений переноса: вывод уравнения коэффициента диффузии.
- •85.Молекулярная теория явлений переноса: вывод уравнения коэффициента теплопроводности.
- •86.Молекулярная теория явлений переноса: вывод уравнения коэффициента вязкости.
- •87.Силы и потенциальная энергия межмолекулярного взаимодействия.
- •88.Вывод уравнения Ван-дер-Ваальса.
- •89.Изотермы Ван-дер-Ваальса.
- •Часть 7—6 — отвечает газообразному состоянию;
- •Часть 2—1 — жидкому;
- •Часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
- •90.Фазовые переходы. Уравнения Клайперона-Клаузиуса.
- •91.Поверхностное натяжение в жидкостях.
- •92.Смачивание
- •93.Капиллярные явления. Формула Лапласса.
- •94.Строение твердых тел. Классификация элементарных ячеек.
- •95.Дефекты кристаллических решеток.
- •96.Температура. Температурные шкалы. Способы измерения.
19.I начало термодинамики в изотермическом процессе.
I
начало ТД для изотермического процесса:
в изотермическом процессе все
количество теплоты, передаваемое
системе, идет на совершение системой
работы по расширению. В дифференциальной
форме для одного моля:
![]() .
.
20.Адиабатический процесс. Уравнение адиабаты. График адиабаты.
Адиабатический процесс - процесс, происходящий в изолированной системе, когда нет теплообмена с окружающей средой.
Для адиабатического
процесса
![]() и I начало ТД в дифференциальной
форме
и I начало ТД в дифференциальной
форме
![]() .
С учетом зависимости внутренней энергии
от температуры:
.
С учетом зависимости внутренней энергии
от температуры:
![]()
I
начало ТД для адиабатического процесса:
в адиабатическом процессе система
совершает работу за счет убыли внутренней
энергии
![]() ,
и наоборот, работа, совершаемая над
системой идет на увеличение ее внутренней
энергии
,
и наоборот, работа, совершаемая над
системой идет на увеличение ее внутренней
энергии
![]() .
.
Получим из I начала ТД и уравнения состояния идеального газа уравнение адиабатического процесса (уравнение адиабаты).
Продифференцируем уравнение состояния для одного моля идеального газа .
![]()
![]() ,
подставим в I начало ТД
,
подставим в I начало ТД
![]() ,
перегруппируем подобные слагаемые,
,
перегруппируем подобные слагаемые,
![]() приведем выражение
в скобке к общему знаменателю
приведем выражение
в скобке к общему знаменателю
![]() учтем соотношение
Майера
учтем соотношение
Майера
![]() и разделим на
и разделим на
![]()
![]() ,
введем обозначение отношения
,
оно называется - показатель адиабаты.
Разделим переменные и решим дифференциальное
уравнение, взяв интеграл:
,
введем обозначение отношения
,
оно называется - показатель адиабаты.
Разделим переменные и решим дифференциальное
уравнение, взяв интеграл:
![]()
![]()
![]()
![]() отсюда
отсюда
![]()
![]()
![]() .
.
Уравнение адиабаты
![]() ,
было получено Пуассоном, и
,
было получено Пуассоном, и
![]() еще называют коэффициентом Пуассона.
Учитывая уравнение состояния, для
уравнения адиабаты есть и другие способы
записи:
еще называют коэффициентом Пуассона.
Учитывая уравнение состояния, для
уравнения адиабаты есть и другие способы
записи:
![]() ,
,
![]() .
.
Уравнения Пуассона
применимы только для описания
квазистатических адиабатических
процессов, уравнения справедливы лишь
в интервале давлений, где величина
постоянная. Т.к.
![]() ,
то при адиабатическом сжатии газ
нагревается, а при адиабатическом
расширении – охлаждается.
,
то при адиабатическом сжатии газ
нагревается, а при адиабатическом
расширении – охлаждается.
В общем случае
нужно учитывать, что
функция
![]() ,
т.е.
,
т.е.
![]() .
.
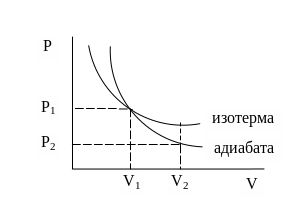
Уравнение адиабаты на диаграмме состояний в -координатах представляет собой гиперболу, положение которой зависит от , но график идет круче чем изотерма для той же системы, т.к. при увеличении объема давление уменьшается быстрее. Если газ переходит из состояния в состояние , то площадь под графиком изотермы больше, чем площадь под графиком адиабаты и, следовательно, система изотермическом процессе совершает большую работу, чем в адиабатическом процессе при том же расширении.
Вычислим работу, совершаемую идеальным газом в адиабатическом процессе расширения от объема до объема :
 ,
если вынести из скобок
,
если вынести из скобок
![]() ,
учесть
,
учесть
 то получим более простые выражения
то получим более простые выражения
![]() .
.
Каждое выражение можно использовать для вычисления численного значения произведенной работы в конкретном процессе.
Таким образом,
работа при одном и том же изменении
объема в адиабатическом процессе меньше,
чем в изотермическом процессе. Но она
существенно зависит от показателя
адиабаты
.
При значении
![]() величина работы стремится к значению
при изотермическом процессе.
величина работы стремится к значению
при изотермическом процессе.
21.I начало термодинамики в адиабатическом процессе.
I начало ТД для адиабатического процесса: в адиабатическом процессе система совершает работу за счет убыли внутренней энергии , и наоборот, работа, совершаемая над системой идет на увеличение ее внутренней энергии .
