
- •1.Предмет и задачи тд. Модели тд.
- •2.Модели тд. Объяснение агрегатных состояний вещества.
- •3.Методы тд.
- •4.Исходные понятия тд.
- •5.Постулаты термодинамики.
- •6.Начала тд.
- •7.Термическое и калорическое уравнения состояния. Термическое уравнение состояние идеального газа.
- •8.Внутренняя энергия идеального газа. Калорическое уравнение состояние идеального газа.
- •9.I начало термодинамики.
- •I начало тд обобщает закон сохранения энергии для тд процессов: количество теплоты, сообщаемое системе, идет на изменение ее внутренней энергии и совершение системой работы.
- •10.Теплоемкость.
- •11.Теплоемкость идеального газа.
- •12. 13.Теорема о равнораспределении энергии по степеням свободы. Число степеней свободы молекул. Число степеней свободы молекул. Выражение для внутренней энергии идеального газа.
- •14.Изохорический процесс: уравнение, график в pv, pt, vt координатах.
- •15.I начало термодинамики в изохорическом процессе.
- •16.Изобарический процесс: уравнение, график в pv, pt, vt координатах.
- •17. I начало термодинамики в изобарическом процессе.
- •18.Изотермический процесс: уравнение, график в pv, pt, vt координатах.
- •19.I начало термодинамики в изотермическом процессе.
- •20.Адиабатический процесс. Уравнение адиабаты. График адиабаты.
- •21.I начало термодинамики в адиабатическом процессе.
- •22.Политропный процесс. Уравнение политропы, показатель политропы, график политропы.
- •23.I начало термодинамики в политропном процессе.
- •24.Изопроцессы как предельные случаи политропного процесса.
- •25.Обратимые и циклические процессы.
- •26. Тепловые машины. Эффективность работы тепловой машины.
- •27.Холодильные машины. Эффективность работы холодильной машины.
- •28.29.Цикл Карно. К.П.Д. Цикла Карно. Идеальная тепловая машина Карно.
- •30. I Теорема Карно.
- •31.II теорема Карно. Реальные тепловые машины.
- •32.II начало термодинамики в формулировках Кельвина и Клаузиуса.
- •33.Тождество Клаузиуса, неравенство Клаузиуса.
- •34. Понятие энтропии. Свойства энтропии. Размерность.
- •35.Энтропия в обратимых и необратимых процессах.
- •36. Энтропия идеального газа.
- •37.III начало тд. Следствия III начала тд.
- •38.Энтальпия.
- •39.Свободная энергия идеального газа.
- •40.Метод тд потенциалов.
- •С 41 по 46 не разделила!смотреть тут(то что красным)!!!:
- •48.Условия равновесия и устойчивости системы в термостате при постоянном объеме.
- •49.Условия равновесия и устойчивости системы в термостате при постоянном внешнем давлении.
- •50.Условия равновесия и устойчивости системы при постоянных энтропии и давлении.
- •51. Условия равновесия и устойчивости системы при постоянных энтропии и объеме.
- •52.Условия равновесия и устойчивости системы с переменным числом частиц в термостате, при постоянных химическом потенциале и объеме.
- •53. Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
- •54.Принцип Ле Шателье-Брауна. Примеры проявления принципа Ле Шателье-Брауна.
- •55.Начала статистической физики: исходные понятия теории вероятности.
- •56.Начала статистической физики: макро- и микросостояния, статистический ансамбль, микроканонический ансамбль, постулат равновероятности.
- •57.Начала статистической физики: эргодическая гипотеза, статистический вес, статистическое толкование энтропии.
- •58.Начала статистической физики: флуктуации.
- •65.Характерные скорости распределения Максвелла: средняя квадратичная скорость.
- •66.Характерные скорости распределения Максвелла: наиболее вероятная скорость.
- •67. Подсчет числа молекул скорости, которых лежат в заданном диапазоне.
- •68.Экспериментальная проверка закона распределения.
- •69.Вывод основного уравнения молекулярно-кинетической теории идеального газа.
- •70.Вывод уравнения состояния. Закон Дальтона. Закон Авогадро.
- •71.72.( Не разделены!)Распределение Больцмана. (72)Барометрическая формула.
- •73.Экспериментальное определение постоянной Авогадро.
- •74.Теорема о равнораспределении энергии по степеням свободы.
- •75.Расхождение теории теплоемкости идеального газа с экспериментом.
- •76.Статистика Ферми-Дирака (подсчет числа микросостояний, функция распределения).
- •77.Статистика Бозе-Эйнштейна (подсчет числа микросостояний, функция распределения).
- •78.Длина свободного пробега.
- •79.Частота столкновений в единицу времени, понятие физического вакуума.
- •80.Явления переноса: теплопроводность.
- •81.Явления переноса: диффузия.
- •82.Явления переноса: вязкое трение.
- •83.Молекулярная теория явлений переноса: вывод уравнения переноса параметра .
- •84.Молекулярная теория явлений переноса: вывод уравнения коэффициента диффузии.
- •85.Молекулярная теория явлений переноса: вывод уравнения коэффициента теплопроводности.
- •86.Молекулярная теория явлений переноса: вывод уравнения коэффициента вязкости.
- •87.Силы и потенциальная энергия межмолекулярного взаимодействия.
- •88.Вывод уравнения Ван-дер-Ваальса.
- •89.Изотермы Ван-дер-Ваальса.
- •Часть 7—6 — отвечает газообразному состоянию;
- •Часть 2—1 — жидкому;
- •Часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
- •90.Фазовые переходы. Уравнения Клайперона-Клаузиуса.
- •91.Поверхностное натяжение в жидкостях.
- •92.Смачивание
- •93.Капиллярные явления. Формула Лапласса.
- •94.Строение твердых тел. Классификация элементарных ячеек.
- •95.Дефекты кристаллических решеток.
- •96.Температура. Температурные шкалы. Способы измерения.
22.Политропный процесс. Уравнение политропы, показатель политропы, график политропы.
Политропный
процесс - процесс, при котором
теплоемкость системы остается постоянной
![]() .
При таком процессе происходит частичный
теплообмен системы с окружающей средой.
.
При таком процессе происходит частичный
теплообмен системы с окружающей средой.
Это самый общий процесс, т.к. полностью исключить теплообмен системы с окружающей средой практически невозможно.
I начало ТД для политропного процесса: количество теплоты, передаваемое системе, идет на изменение ее внутренней энергии и совершение системой работы. В дифференциальной форме для одного моля с учетом теплоемкости:
![]()
Получим из I начала ТД и уравнения состояния идеального газа уравнение политропного процесса (уравнение политропы)
Продифференцируем уравнение состояния для одного моля идеального газа .
, подставим в I начало ТД
![]()
![]() ,
перегруппируем подобные слагаемые,
,
перегруппируем подобные слагаемые,
![]()
![]() учтем соотношение
Майера
учтем соотношение
Майера
![]() разделим на
разделим на
![]()
![]() ,
введем обозначение отношения
,
введем обозначение отношения
![]() ,
оно называется - показатель политропы.
,
оно называется - показатель политропы.
Разделим переменные и решим дифференциальное уравнение, взяв интеграл:
![]()
![]()
![]()
![]() отсюда
отсюда
![]()

![]()
![]() .
.
Уравнение политропы
![]() .
.
Учитывая уравнение состояния, для уравнения политропы, аналогично уравнению адиабаты, есть и другие способы записи:
![]() ,
,
![]() .
.
График политропы на диаграмме состояний в - координатах представляет собой гиперболу, занимающую промежуточное положение между изотермой и адиабатой.
Работа, совершаемая в политропном процессе, вычисляется аналогично работе в изобарическом процессе:

![]() .
.
Е
сли
![]() ,
то
,
то
![]() работа совершается над газом, газ
сжимается.
работа совершается над газом, газ
сжимается.
Изменение внутренней энергии в этом процессе , как и для всех других процессов в идеальном газе.
Для молей вещества .
Числовые значения
показателя политропы
![]() определяются опытным путем.
определяются опытным путем.
Зависимость
теплоемкости
![]() от
для идеального газа показана на графике.
от
для идеального газа показана на графике.
23.I начало термодинамики в политропном процессе.
I начало ТД для политропного процесса: количество теплоты, передаваемое системе, идет на изменение ее внутренней энергии и совершение системой работы. В дифференциальной форме для одного моля с учетом теплоемкости:
24.Изопроцессы как предельные случаи политропного процесса.
Все изопроцессы могут быть рассмотрены, как предельные случаи политропного процесса.
адиабатический процесс
 .
.
В этом процессе
![]() ,
показатель политропы превращается в
показатель адиабаты
,
показатель политропы превращается в
показатель адиабаты
![]() .
.
![]() уравнение политропы
превращается в уравнение адиабаты.
уравнение политропы
превращается в уравнение адиабаты.
![]() ,
,
,
,
![]() .
.
изотермический процесс .
В этом процессе
![]() ,
показатель политропы равен единице
,
показатель политропы равен единице
![]() .
.
![]() уравнение политропы
превращается в уравнение изотермы.
уравнение политропы
превращается в уравнение изотермы.
, , .
изобарический процесс .
В этом процессе
![]() ,
показатель политропы равен нулю
,
показатель политропы равен нулю
![]() .
.
![]() ,
уравнение политропы превращается в
уравнение изобары.
,
уравнение политропы превращается в
уравнение изобары.
![]() ,
,
,
,
![]() ,
,
![]() .
.
изохорический процесс .
В этом процессе
![]() ,
показатель политропы равен бесконечности
,
показатель политропы равен бесконечности
![]() .
.
![]() ,
уравнение политропы превращается в
уравнение изохоры.
,
уравнение политропы превращается в
уравнение изохоры.
,
![]() ,
.
,
.
25.Обратимые и циклические процессы.
В некоторой изолированной системе тело переходит из состояния 1 в состояние 2, а затем возвращается в состояние 1.
П роцесс
называется обратимым, если возможно
осуществить обратный переход через те
же промежуточные состояния, так, чтобы
не осталось никаких изменений в окружающей
среде.
роцесс
называется обратимым, если возможно
осуществить обратный переход через те
же промежуточные состояния, так, чтобы
не осталось никаких изменений в окружающей
среде.
Если такой процесс осуществить нельзя, если по окончании процесса в окружающих телах или в самом теле остались какие-либо изменения, то процесс является необратимым.
Любой процесс, сопровождаемый трением, необратим, ибо часть работы при трении всегда превращается в тепло. Трущиеся поверхности нагреваются, и теплота распространяется, рассеивается в окружающих телах. Рассеянная теплота ни при каких процессах не может без затрат энергии, без совершения работы другим телом собраться к трущимся поверхностям и вновь превратится в работу.
Любой реальный механический процесс сопровождается трением и поэтому является необратимым.
Все процессы, сопровождающиеся теплопередачей от нагретого тела к менее нагретому телу, являются необратимыми. Т.к. обратный переход теплоты от холодного тела к нагретому телу, который может быть осуществлен в холодильной машине, не идет сам собой. Для осуществления такого процесса требуется затрата работы еще какого-либо тела, что приводит к изменению в этом теле, и следовательно условие обратимости не выполняются.
Необратимым является процесс расширения газа, даже идеального в пустоту. При таком расширении газ не совершает работы, а чтобы собрать вновь вместе газовые молекулы, сжать газ, привести в начальное состояние, требуется затратить работу, что приведет к изменениям в других телах.
Т.о. все реальные процессы являются необратимыми, хотя степень необратимости может быть разная.
Обратимыми являются квазистатические равновесные процессы. Абстрактные, идеализированные процессы.
Процесс, при котором тело проходить через ряд различных состояний, а в результате возвращается в исходное, начальное состояние называется круговым или цеклическим. Круговой процесс является обратимым, если все его части обратимы. Если какая-либо часть процесса является необратимой, то процесс необратим.
Н а
диаграмме состояний в
-координатах
круговой процесс представляет собой
замкнутую кривую. В процессе, происходящем
по часовой стрелке 1а2в1, теплота
превращается в механическую работу. В
процессе идущем против часовой стрелки
1в2а1 механическая энергия превращается
в теплоту, точки 1 и 2 соответствуют
начальному и промежуточному значениям
давлений и объемов
,
.
а
диаграмме состояний в
-координатах
круговой процесс представляет собой
замкнутую кривую. В процессе, происходящем
по часовой стрелке 1а2в1, теплота
превращается в механическую работу. В
процессе идущем против часовой стрелки
1в2а1 механическая энергия превращается
в теплоту, точки 1 и 2 соответствуют
начальному и промежуточному значениям
давлений и объемов
,
.
Система, которая совершает круговой процесс, обмениваясь энергией (теплотой) с внешней средой называют рабочим телом.
Система после
получения в начальном состоянии 1
определенное количество теплоты
![]() от нагревателя совершает положительную
работу
от нагревателя совершает положительную
работу
![]() и переходит в промежуточное состояние 2.
Затем после теплового контакта с
холодильником, она отдает ему часть
количества теплоты
и переходит в промежуточное состояние 2.
Затем после теплового контакта с
холодильником, она отдает ему часть
количества теплоты
![]() и за счет совершения работы над системой
и за счет совершения работы над системой
![]() ,
возвращается в исходное состояние 1.
,
возвращается в исходное состояние 1.
Т.к. после окончания кругового процесса рабочее тело возвращается в исходное состояние, его внутренняя энергия не изменяется. Поэтому рабочее тело может совершать работу только за счет внешних источников, подводящих к нему теплоту.
Т.о. изолированная система в целом не может совершить круговой процесс, т.к. требуется участие внешних сил, внешних источников тепла.
Р абота,
совершаемая за круговой процесс (цикл)
рабочим телом, равна площади внутри
замкнутой кривой кругового процесса.
абота,
совершаемая за круговой процесс (цикл)
рабочим телом, равна площади внутри
замкнутой кривой кругового процесса.
![]() ,
,
![]() ,
,
![]() .
.
В принципе существует бесчисленное множество возможных циклов, поскольку каждой замкнутой кривой, на диаграмме в - координатах соответствует цикл. Можно представить различные круговые процессы, используя уже изученные процессы и их комбинации. Например, процессы, изображенные в - координатах:
а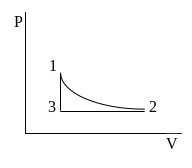 )
круговой процесс, в котором рабочее
тело совершает два изобарических (1-2,
4-3) и два изохорических процесса (2-3,
4-1);
)
круговой процесс, в котором рабочее
тело совершает два изобарических (1-2,
4-3) и два изохорических процесса (2-3,
4-1);
б )
круговой процесс, в котором рабочее
тело совершает изотермический
(1-2),
затем изобарический (2-3) и изохорический
(3-1) процессы;
)
круговой процесс, в котором рабочее
тело совершает изотермический
(1-2),
затем изобарический (2-3) и изохорический
(3-1) процессы;
в) круговой процесс, в котором рабочее тело совершает адиабатический (1-2), затем изобарический (2-3) и изохорический (3-1) процессы;
г) круговой процесс, в котором рабочее тело совершает два изотермических (1-2, 3-4) и два адиабатических (2-3, 4-1) процесса.

