
40)Амплитудой
вероятности Ψ(х,
y,z,t).
называют
так-же волновой
функцией.
Амплитуда вероятности может быть
комплексной, и вероятность W
пропорциональна
квадрату ее модуля:
![]()
Статистический, вероятностный характер: квадрат модуля волновой функции (квадрат модуля амплитуды волн
де Бройля) определяет вероятность на-хождения частицы в момент времени t в области с координатами хи х + dx, у и у + dy, z и z+ dz.
Вероятность
нахождения частицы в элементе объемом
dV
равна![]()
Величина
(квадрат модуля Ψ-функции)
![]() имеет
смысл плотности
вероятности, т.
е. определяет вероятность нахождения
частицы в окрестности точки с координатами
х,
у, z. Таким
образом, физический смысл имеет не сама
Ψ-функция, а квадрат ее модуля |Ψ|2,
ко-торым задается интенсивность
воли де
Бройля.
имеет
смысл плотности
вероятности, т.
е. определяет вероятность нахождения
частицы в окрестности точки с координатами
х,
у, z. Таким
образом, физический смысл имеет не сама
Ψ-функция, а квадрат ее модуля |Ψ|2,
ко-торым задается интенсивность
воли де
Бройля.
Вероятность
найти частицу в момент времени t
в
конечном объеме 1/, согласно теореме
сложения вероятностей, равна![]()
Условие нормировки вероятностей
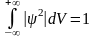
Функция Ψ должна быть конечной (вероятность не может быть больше единицы), однозначной (вероятность не может быть неоднозначной величиной) и непрерывной (вероятность не может изменяться скачком).
Уравнение
Шредингера имеет вид![]()
![]()
![]() —
мнимая
единица.U(x,
y,z,t) —потенциальная
функция частицы в силовом поле, в котором
она движется; Ψ(х, у,
z,t) — искомая
волновая функция частицы.
—
мнимая
единица.U(x,
y,z,t) —потенциальная
функция частицы в силовом поле, в котором
она движется; Ψ(х, у,
z,t) — искомая
волновая функция частицы.
Уравнение справедливо для любой частицы, движущейся с малой скоростью, v <C. Оно дополняется условиями: 1) волновая функция должна быть конечной, одно значной и непрерывной; 2)производные должны быть непрерывны; 3) функция |Ψ|^2должна быть интегрируема;
Чтобы прийти к уравнению Шредингера рассмотрим свободно движущуюся частицу, которой, сопоставляется плоская волна.Уравнение плоской волны, ξ(х, t) = A cos (ωt - кх),
Плоская
волна де Бройля имеет вид![]()
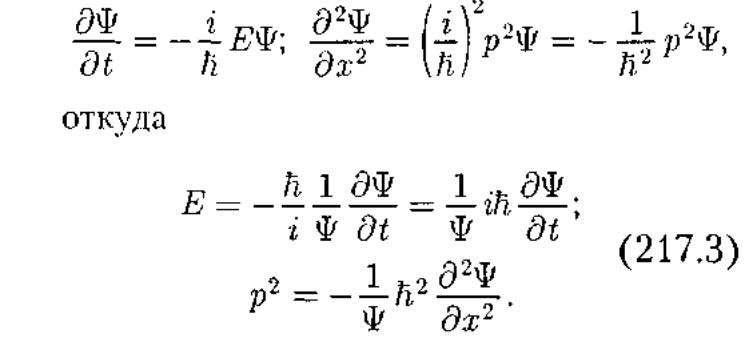
![]()
Уравнение
Шредингера для стационарных состояний:
![]()
Это возможно, если силовое поле, в котором частица движется, стационарно, т. е. функция U= U(x, у, z) не зависит явно от времени и имеет смысл потенциальной энергии.
Принцип причинности — принцип классического детерминизма:по известному состоянию системы в некоторый момент времени (полностью определяется значениями координат и импульсов всех частиц системы) и силам, приложенным к ней, можно абсолютно точно задать ее состояние в любой последующий момент.
41) Свободная частица — частица, дви-жущаяся в отсутствие внешних полей. Так как на свободную частиц)' (пусть она движется вдоль оси х) силы не действуют, то потенциальная энергия частицы U(x) = const и ее можно принять равной нулю. Тогда полная энергия частицы совпадает с ее кинетической энергией. В таком случае уравнение Шредингера для стационарных состояний примет вид
![]()
Энергия свободной частицы может принимать любые значения, т. е. энергетический спектр свободной частицы является непрерывным. Все положения свободной частицы в пространстве являются равновероятными.
Проведем анализ решений уравнения
Шредингера
приме-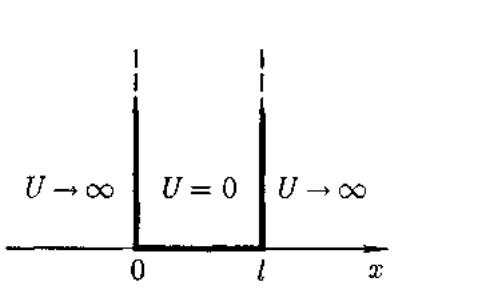 нительно
к частице в
одномерной
прямоугольной ≪потенциальной
яме≫
с бесконечно высокими ≪стенками≫.
нительно
к частице в
одномерной
прямоугольной ≪потенциальной
яме≫
с бесконечно высокими ≪стенками≫.
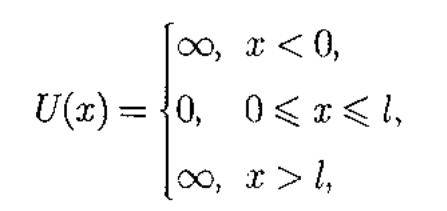 где
l—
ширина
≪ямы≫,
где
l—
ширина
≪ямы≫,
Уравнение Шредингера
![]()
Частица не проникает за пределы ≪ямы≫, поэтому вероятность ее обнаружения (волновая функция) за пределами ≪ямы≫равна нулю. Граничные условия имеют вид.Ψ(0) =Ψ(l) = 0.
В пределах ≪ямы≫ :
![]()
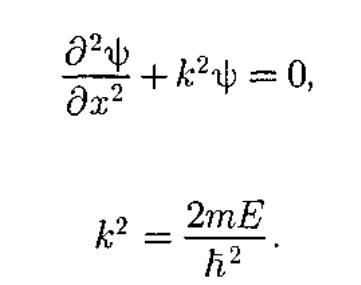
Общее
решение дифференциального уравнения:
![]() Так
как Ψ(0) = 0, то В
=
0.
Так
как Ψ(0) = 0, то В
=
0.
Тогда
![]()
Условие Ψ(х) = Asinkl = 0
выполняется только при kl= nπ, где п —
целые
числа, т. е. необходимо, чтобы![]() Тогда
Тогда![]() т.е.
стационарное уравнение Шредингера,
удовлетворяется только при собственных
значениях Еп,
зависящих
от целого числа п.
т.е.
стационарное уравнение Шредингера,
удовлетворяется только при собственных
значениях Еп,
зависящих
от целого числа п.
Следовательно, энергия Еп частицы в ≪потенциальной яме≫ с бесконечно высокими ≪стенками≫ принимает лишь определенные дискретные значения, т. е.квантуется.
Квантованные значения энергии Еп называются уровнями энергии, а число п, определяющее энергетические уровни частицы, называется главным квантовым числом. Таким образом, микрочастица в ≪потенциальной яме≫ с бесконечно высокими ≪стенками≫ может находиться только на определенном энергетическом уровне Еп, или, как говорят, частица находится в квантовом состоянии п.
Туннельный эффекта –квантовое явление, в результате которого микрообъект может ≪пройти≫ сквозь потенциальный барьер. Для описания туннельного эффекта используют понятие коэффициента прозрачности D, определяемого как отношение плотности потока прошедших частиц к плотности потока падающих.
![]() Для
того чтобы найти отношение, необходимо
воспользоваться условиями непрерывности
Ψ и Ψ′ на границах барьера х
= 0
и х
= l
Для
того чтобы найти отношение, необходимо
воспользоваться условиями непрерывности
Ψ и Ψ′ на границах барьера х
= 0
и х
= l
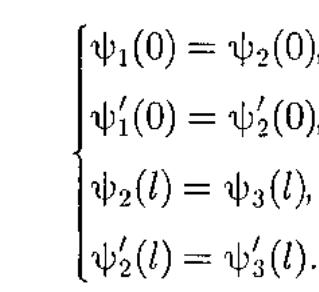
Совместное
решение уравнений для прямоугольного
потенциального барьера дает
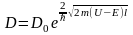

D0 - постоянный множитель, который можно приравнять единице; U —высота потенциального барьера; Е —энергия частицы; / — ширина барьера. Чем шире барьер, тем меньше вероятность прохождения сквозь него частицы.
Для потенциального барьера произвольной формы, удовлетворяющей условиям ква-зиклассического приближения (достаточно гладкая форма кривой), имеем
![]() где
U=
U(x).Туннельный эффект является
специфическим квантовым эффектом.
где
U=
U(x).Туннельный эффект является
специфическим квантовым эффектом.
Линейный гармонический осциллятор — система, совершающая одномерное движение под действием квазиупругой силы.Пружинный, физический и математический маятники — примеры классических гармонических осцилляторов. Потенциальная энергия гармонического осциллятора равна
![]() где
ω0 — собственная частота колебаний
осциллятора; т
— масса
частицы. Амплитуда малых колебаний
классического осциллятора определяется
его полной энергией Е
где
ω0 — собственная частота колебаний
осциллятора; т
— масса
частицы. Амплитуда малых колебаний
классического осциллятора определяется
его полной энергией Е
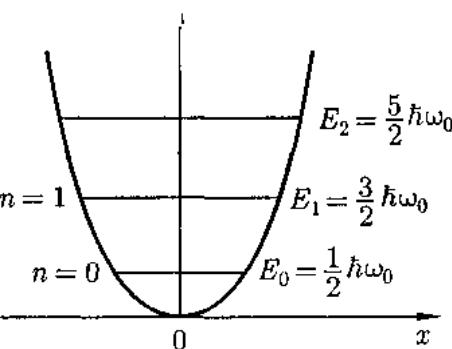 Гармонический
осциллятор в квантовой механике —
квантовый
осциллятор.
Стационарные состояния квантового
осциллятора определяются уравнением
Шредингера
Гармонический
осциллятор в квантовой механике —
квантовый
осциллятор.
Стационарные состояния квантового
осциллятора определяются уравнением
Шредингера
![]() =
0,
=
0,
где Е — полная энергия осциллятора.
![]() Формула
показывает, что энергия квантового
осциллятора может иметь лишь дискретные
значения, т.
е. квантуется.
Формула
показывает, что энергия квантового
осциллятора может иметь лишь дискретные
значения, т.
е. квантуется.
42) Согласно модели Томсона, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что это представление ошибочно
Резерфорд в 1911 г. предложил ядерную {планетарную) модель атома.Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z —порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10-15—10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра должно вращаться Z электронов.
Уравнение, описывающее движение электрона в атоме по окружности под действием кулоновской силы:
![]() где
ξ0 — электрическая постоянная; те
и v
— масса
и скорость электрона на орбите радиусом
г.
где
ξ0 — электрическая постоянная; те
и v
— масса
и скорость электрона на орбите радиусом
г.
Бальмер
подобрал формулу, описывающую все
известные спектральные линии атома
водорода в видимой
области спектра:
![]() где
R'
=
1,10*107
м-1
—
постоянная
Ридберга.
где
R'
=
1,10*107
м-1
—
постоянная
Ридберга.
![]() где
R=R'c
= 3.29
• 1015
с-1-также
постоянная Ридберга. Спектральные
линии, отличающиеся различными значениями
п,
образуют серию линий, называемую серией
Бальмера.
где
R=R'c
= 3.29
• 1015
с-1-также
постоянная Ридберга. Спектральные
линии, отличающиеся различными значениями
п,
образуют серию линий, называемую серией
Бальмера.
В улыпрафиолетовой области спектра находится серия Лаймена
![]()
В инфракрасной области спектра:
Серия Пашена
![]()
Серия Брэкета
![]()
Серия Пфунда
![]()
Серия Хэмфри
![]() Все
приведенные выше серии в спектре атома
водорода могут быть описаны одной
формулой, обобщенной
формулой Балъмера:
Все
приведенные выше серии в спектре атома
водорода могут быть описаны одной
формулой, обобщенной
формулой Балъмера:
![]() где
т
имеет
в каждой данной серии постоянное
значение, т
— 1,2,3,4,5,6
(определяет
серию), п принимает
целочисленные значения, начиная c m+1
(оп-ределяет
отдельные линии этой серии).
где
т
имеет
в каждой данной серии постоянное
значение, т
— 1,2,3,4,5,6
(определяет
серию), п принимает
целочисленные значения, начиная c m+1
(оп-ределяет
отдельные линии этой серии).
43)
Первый постулат Бора (постулат
стационарных состояний): в
атоме существуют стационарные (не
изменяющиеся со временем) состояния,
в
которых
он не излучает энергии; эти состояния
характеризуются определенными
дискретными значениями энергии.
![]() где
mе.
—
масса электрона; v
— его
скорость по n-й
орбите радиуса rn;
где
mе.
—
масса электрона; v
— его
скорость по n-й
орбите радиуса rn;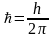
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией hv = En-Em, равной разности энергий соответствующих стационарных состояний [Еп и Ет — соответственно энергии стационарных состояний атома до и после излучения (поглощения)].
При Еm < Еп происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Ет > Еп — его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту).
Спектр атома водорода по Бору: водородоподобные системы — системы, состоящие из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+).
Рассмотрим
движение
электрона
в водородоподобной системе. Решая
совместно уравненис
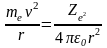 и
получим
выражение радиуса n-ой
стационарной орбиты:
и
получим
выражение радиуса n-ой
стационарной орбиты:
Из этого выражения следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z = 1) радиус первой орбиты электрона при п = 1, называемый первым боровским радиусом (а), равен
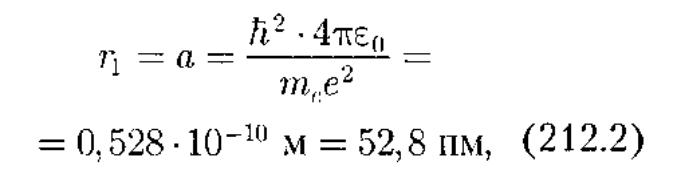
Полная энергия электрона в водородоподобной системе
![]() [учли,
что
[учли,
что![]() ].
].
Учитывая квантованные для радиуса n-й стационарной орбиты значения, получим, что энергия электрона может принимать только следующие дискретные значения: где знак ≪--≫ означает, что электрон находится в связанном состоянии.
![]()
Целое число п в выражении (212.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с п = 1 является основным (нормальным) состоянием; состояния с п > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
Опыты Франка и Герца:
Изучая методом задерживающего потенциала столкновения электронов с атомами газов (1913), Д.Франк и Г. Герц экспериментально доказали дискретность значений энергии атомов.
Схема
их установки приведена на рис.Вакуумная
трубка, заполненная парами ртути
(давление приблизительно равно 13 Па),
содержала катод (К), две сетки(С1
и
С2) и анод (А). Электроны ускорялись
разностью потенциалов, приложенной
между катодом и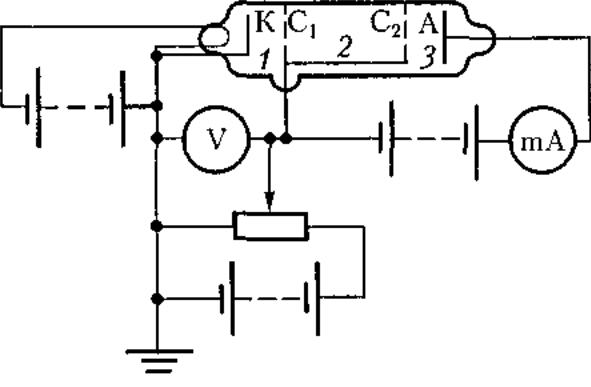 сеткой С1.
Между
сеткой С2 и анодом приложен небольшой
задерживающий потенциал.
сеткой С1.
Между
сеткой С2 и анодом приложен небольшой
задерживающий потенциал.
Электроны,
ускоренные в области 1, попадают в
область 2
между
сетками, где испытывают соударения с
атомами паров ртути. Электроны, которые
после соударений имеют достаточную
энергию для преодоления задерживающего
потенциала в области 3,
достигают
анода. При неупругих соударениях
электронов с атомами ртути последние
могут возбуждаться. Согласно боровской
теории, каждый из атомов ртути может
получить лишь вполне определенную
энергию, переходя при этом в одно из
возбужденных состояний. Поэтому если
в атомах действительно существуют
стационарные состояния, то электроны,
сталкиваясь с атомами ртути, должны
терять энергию дискретно, определенными
порциями, равными разности энергий
соответствующих стационарных состояний
атома.
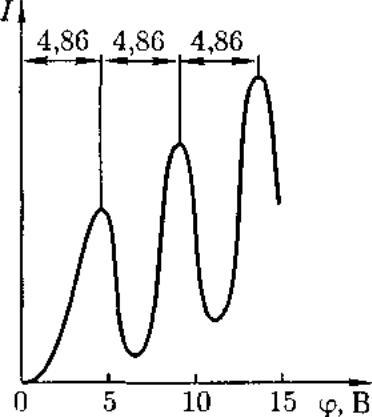
Из опыта следует (рис. 296), что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при 2*4,86 и 3*4,86 В.
Опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ — наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии.
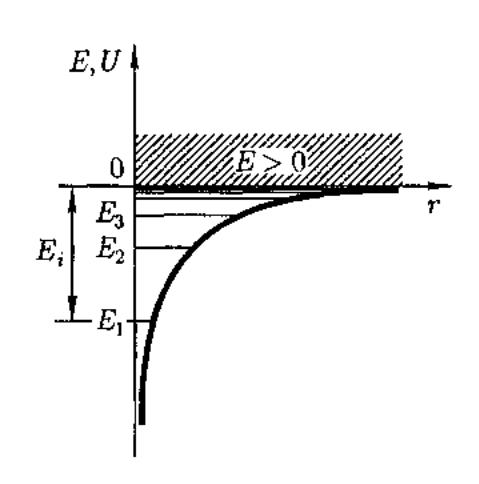
44) Потенциальная энергия взаимодей-
ствия электрона с ядром, обладающим
зарядом Ze (для атома водорода Z=1),
![]()
где r — расстояние между электроном
и ядром.
Графически функция U(r) изображе-
на жирной кривой на рис.U(r) с
уменьшением r(при приближении
электрона к ядру) неограниченно убы-
вает.
Состояние электрона в атоме водорода описывается волновой функцией Ψ
![]()
1. Энергия.
![]()
Самый нижний уровень Е{, отвечающий минимальной возможной энергии, — основной, все остальные (Еп > Е1 п = 2,3,...) — возбужденные . При Е < 0 движение электрона является связанным . При Е > 0 движение электрона является свободным;
Энергия
ионизации атома водорода равна![]()
2. Квантовые числа.
Главное квантовое число п определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы:
Из
решения уравнения Шредингера вытекает,
что момент
импульса (механический
орбитальный момент) электрона
квантуется, т.
е. не может быть произвольным, а принимает
дискретные значения, определяемые по
формуле![]()
где l — орбитальное квантовое число, которое при заданном п принимает значения 1=0,1, . . . , п - 1), т.е. всего п значений, и определяет момент импульса электрона в атоме.
Llz =ħml ml - магнитное квантовое число,
Таким образом, магнитное квантовое число т, определяет проекцию момента импульса электрона на заданное направление. причем вектор момента импульса электрона в атоме может иметь в пространстве 21 + 1 ориентации.
Расщепление энергетических уровней в магнитном поле получило название эффекта Зеемана. Расщепление уровней энергии во внешнем электрическом поле называется эффектом Штарка.
Квантовые числа п и l характеризуют размер и форму электронного облака, а квагпповое число ml ~ ориентацию электронного облака в пространстве.
l= 0, называют s-состоянием (электрон в этом состоянии называют s-электроном), l—1 — p-состоянием, l=2 —d-состоянием, l = 3 — f-состоянием и т. д.
3. Спектр. Квантовые числа l, п и ml позволяют более полно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора.
В квантовой механике вводятся правила отбора для дипольного излучения:
1) изменение орбитального квантового числа удовлетворяет условию
![]() 2)
изменение магнитного квантового числа
удовлетворяет условию
2)
изменение магнитного квантового числа
удовлетворяет условию
![]()
45)Основное состояние атома водорода
ls-Состояние электрона в атоме водорода является сферически-симметричным.
Уравнению
Шредингера для ls-состояния электрона
в атоме водорода удовлетворяет функция
вида
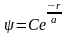
где,
![]() величина,
совпадающая с первым боровским радиусом
а
для
атома водорода; С
— некоторая
постоянная, определяемая из условия
нормировки вероятностей.
величина,
совпадающая с первым боровским радиусом
а
для
атома водорода; С
— некоторая
постоянная, определяемая из условия
нормировки вероятностей.
![]()
После интегрирования получим
![]()
Нормированная
волновая функция, отвечающая 1s-состоянию
электрона в атоме водорода:
![]()
Вероятность обнаружить электрон в элементе объема равна
![]()
Подставив
в эту формулу волновую функцию, получим
плотность вероятности![]()
![]()
Согласно квантовой механике, плотность вероятности лишь
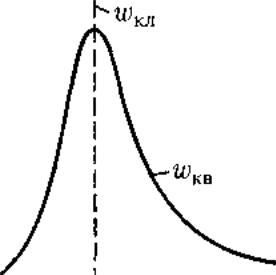 при
r
= а достигает максимума, оставаясь
отличной от нуля во всем пространстве.
Таким образом, в основном состоянии
атома водорода наиболее вероятным
расстоянием от электрона до ядра
является расстояние, равное боровскому
радиусу. В этом заключается
кваптово-механический смысл боровского
радиуса.
при
r
= а достигает максимума, оставаясь
отличной от нуля во всем пространстве.
Таким образом, в основном состоянии
атома водорода наиболее вероятным
расстоянием от электрона до ядра
является расстояние, равное боровскому
радиусу. В этом заключается
кваптово-механический смысл боровского
радиуса.
