
- •Предм техн термодин, осн порам состаяния.
- •Параметры состояния
- •2. Смесь газов
- •3. Теплоемкость газа
- •4. Первый закон термодинамики его аналитическое выр
- •Внутренняя энергия
- •5. Работа расширения, энтальпия, энтропия.
- •6.Термодинамические проц.
- •7. Адиабатный процесс
- •8. Политропный процесс, вывод политропы
- •10. Прям и обр цикл Карно
- •13. Многоступ сжатие
- •14. Цикл двиг с подводом теплоты при пост обьёме
- •15. Газотурбинные устан. Циклы газотурбинных установок (гту)
- •16. Реальные газы. Уравнения Ван дер Вальса
- •18 HS диагр водян пара. Общ метод исл термодин прц водян пара
- •19. Определ порам водяного пара по табл
- •20 Схем паросил установки, Цикл Карно
- •21. Циклы паротурбинных установок (пту)
- •22. Способы увеличения кпд цикл Ренкена. Цикл со втор перегр паром.
- •23. Первый закон термодинамики для потока
- •24. 1 Адиабатическое истечение газа через сужив сопло
- •25. Сопло Лаваля. Истеч вод пара через это сопло.
- •26. Дросселирование газов и паров
- •27.1 Классификация холодильн установок, цикл возд компрессии возд устан
- •28.1 Цикл паравой компрессионной холод установки
- •29.1 Цикл абсорбционной холодильной установки
- •30. Влажный воздух hd диагр вл возд
16. Реальные газы. Уравнения Ван дер Вальса
Наиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса:
(P + a/2)·( – b) = R·T .
а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул. a/2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/2 внешнее давление легко изменяет их объем. Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо. На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре. Точка А соответствует состоянии жидкости, точка В относится парообразному состоянии вещества.
18 HS диагр водян пара. Общ метод исл термодин прц водян пара
Давление
насыщения:
 .
.
Температура
насыщения:
 .
.
Теплота
фазового перехода:
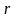 ,
при этом теплота фазового перехода
зависит от давления, то есть
,
при этом теплота фазового перехода
зависит от давления, то есть
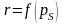 - уравнение фазовых переходов.
- уравнение фазовых переходов.
Определение параметров насыщенного пара.
Дано
давления -
и степень сухости
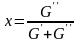 .
.
Любую
характеристику можно определить, как
 .
.

Например:
Удельный
объём:
 .
.
Энтальпия:
 .
.
Энтропия:
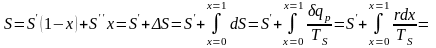
 .
.
Для
полного испарения:
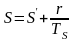 .
.
Диаграмма
 для водяного пара:
для водяного пара:
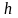
 -
степень перегрева.
-
степень перегрева.
С
помощью графика можно найти
,
,
 ,
,
,
,
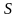 ,
и
.
С помощью этих данных можно вычислить
энергию по формуле:
,
и
.
С помощью этих данных можно вычислить
энергию по формуле:
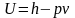 .
.
19. Определ порам водяного пара по табл
Давление насыщения: .
Температура насыщения: .
Теплота фазового перехода: , при этом теплота фазового перехода зависит от давления, то есть - уравнение фазовых переходов.
Определение параметров насыщенного пара.
Дано давления - и степень сухости .
Любую характеристику можно определить, как .
Например:
Удельный объём: .
Энтальпия: .
Энтропия:
.
Для полного испарения: .
Диаграмма для водяного пара:
- степень перегрева.
С помощью графика можно найти , , , , , и . С помощью этих данных можно вычислить энергию по формуле: .
20 Схем паросил установки, Цикл Карно
Паросиловые установки (циклы):
Объекты, производящие тепловую энергию.
Объекты, производящие работу.
Цикл
Карно (рабочее тело – конденсирующий
газ).
Паровые котлы бывают двух типов: прямоточного типа и барабанного типа.
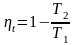
Удельная
работа в турбине
 .
.
Удельная
работа в компрессоре
 .
.
Полезная
удельная работа
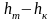 .
.
Эффективный
коэффициент полезного действия системы:
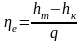 .
.
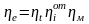 ,
где
,
где
 - относительный индикаторный коэффициент
полезного действия,
- относительный индикаторный коэффициент
полезного действия,
 - индикаторный внутренний коэффициент
полезного действия,
- индикаторный внутренний коэффициент
полезного действия,
 - механический коэффициент полезного
действия.
- механический коэффициент полезного
действия.
