Вариант-69 Контрольная работа №1 Задача №9.
В одноступенчатом компрессоре сжимается адиабатно двуокись углерода до давления р2=0,5 МПа. Начальная температура двуокиси углерода I, =-5°С и давление р, = 0,1 МПа. Определить работу, затраченную на сжатие 1 кг двуокиси углерода, и конечную температуру двуокиси углерода, если показатель адиабаты к = 1,28.
Решение:
Определим конечную температуру двуокиси углерода по формуле:
к-1 1,28-
1щ
И/
к
1,28
= 381 К.
Р2
=
268
Т =Т 1 2 — 1 ,
ЧП /
где, Т, = 1,1273 = -51273 = 268 К - абсолютная температура двуокиси
углерода в начале процесса сжатия.
При адиабатном сжатии работа компрессора в к раз больше работы адиабатного сжатия:
11к—Щ - Т.) = 1,28 ЯрВ (381- 268) = 97,6 кДж/кг. к-Г 2 1 1,28-1
где, К. = 188,9 Дж /(кг • К) 1 газовая постоянная двуокиси углерода,
[1,табл.IV].
Ответ: 1 = 97,6 кДж/кг.
Задача №15.
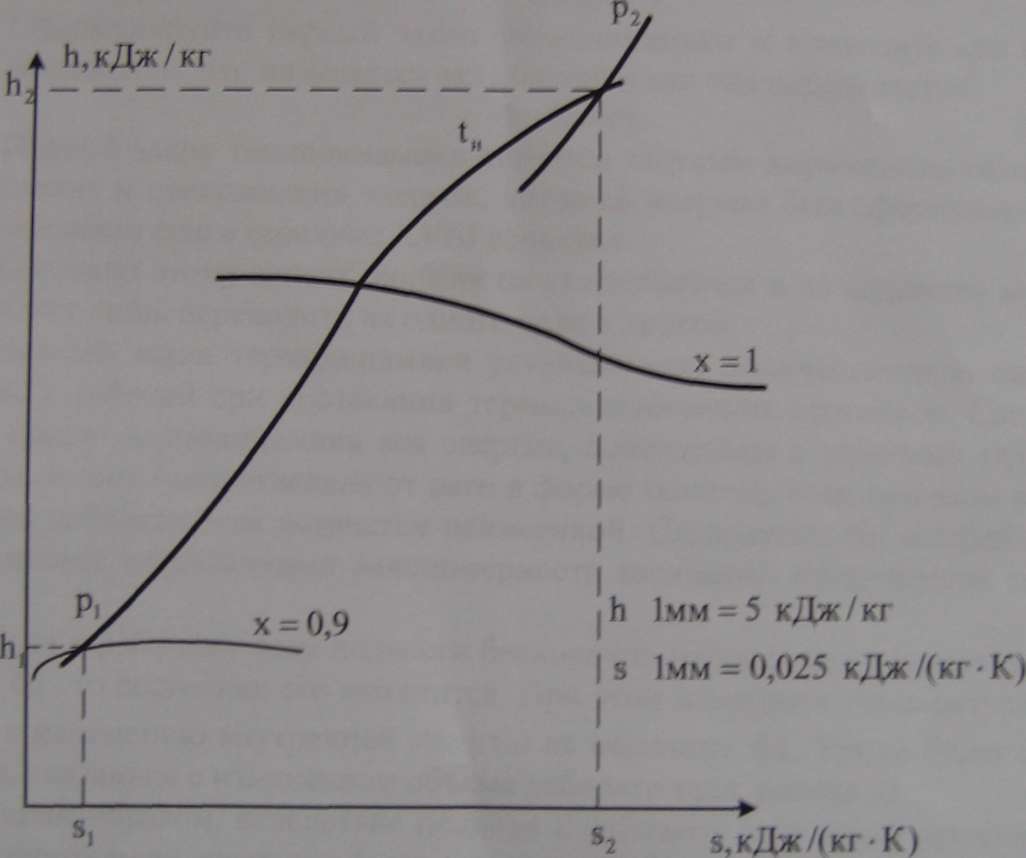
Влажный пар с начальным давлением р, = 6 МПа и степенью сухости х = 0,9 расширяется изотермически до давления р2 = 0,5 МПа. Определить параметры пара в начальном и конечном состояниях, изменение внутренней энергии, количество переданной теплоты пару и работу расширения. Изобразить тепловой процесс в Ьз-диаграмме.
Решение:
Находим на Ьз- диаграмме начальные параметры пара при заданных начальных параметрах р, и х: Ь, = 2626 кДж/кг, V, = 0,0297 м3/ кг, з, =5,6 кДж/(кг -К).
Находим 1И =275° С на пересечении изобары р, и верхней пограничной кривой х = 1.
Находим на Ьз-диаграмме точку пересечения изотермы 1н и линии изобары
р2 и определим параметры пара в конечном состоянии: Ь2 =3013 кДж/кг,
32 = 7,37 кДж/(кг К), у2 = 0,5 м3/кг.
Изменение внутренней энергии определим по формуле: Ли = и2 - и, = (Ь2 - р2У2)-(Ь, - р,у,) =
= (3013 - 0,5 • 103 ■ 0,5) -(2626 - 6 • 103 • 0,0297) = 315,2 кДж /кг
.Количество теплоты участвующее в изотермическом процессе находим по формуле:
ц г Т(§з - в,) = 548 • (7,37 - 5,6)« 970 кДж.
где, Т = 1„ + 273 = 275 + 273 • 548 К - абсолютная температура пара в изо- термическом процессе.
Найдем работу пара по формуле: I = Я - Ли = 968,9- 315,2 = 653,7 кДж,
Ответ: Ди = 315,2 кДж/кг, ч = 970 кДж, 1 = 653,7 кДж.
Задача №22.
Определить плотность теплового потока от воздуха к водному раствору хлорида кальция (рассолу), циркулирующему в плоской батарее камеры хранения скоропортящегося сырья хлебозавода, если стенка батареи покрылась слоем льда толщиной 52=5 мм. Температура в холодильной камере I, = 4'С, средняя температура рассола 1Ж = -5°С, коэффициент теплоотдачи от воздуха ко льду а, = 10 Вт/(м2 - К), коэффициент теплоотдачи от стенки к рассолу а2 = 5000 Вт/(м2' К), коэффициент теплопроводности льда Х2 = 2,25 Вт/(м К), коэффициент теплопроводности стальной стенки X, = 50 Вт/(м • К) и толщина стенки 6, = 1^5 мм,
Решение:Коэффициент теплопередачи для плоской многослойной стенки определим по формуле:
к°1
6, Ч Я 0,0015
^0,005 I ~9'76'
Р^^ + — +— + + — + — +
а, X, к2 а2 10 50 2,25 5000 Плотность теплового потока от воздуха к рассолу определим по формуле: ц = к(*к -гя) = 9,761*(4-(-5)) = 87,85 Вт/м2.
Ответ: ц = 87,85 Вт/м2.
Вопрос 9.
Сформулируйте первый закон термодинамики и приведите его аналитическое выражение. Что называется энтальпией и как она определяется?
Ответ.
Первый закон термодинамики является частным выражением общего закона сохранения и превращения энергии, который впервые был сформулирован М. В. Ломоносовым еще в середине XVIII столетия.
Согласно этому закону энергия не уничтожается и не создается вновь; энергия может лишь переходить из одного вида в другой.
Первый закон термодинамики устанавливает количественную связь между теплом и работой при протекании термодинамических процессов. Согласно первому закону термодинамики вся энергия, подведенная к рабочему телу в форме работы, может быть отведена от него в форме теплоты, если при этом внутренняя энергия рабочего тела останется неизменной. Следовательно, первый закон термодинамики устанавливает закономерности взаимного превращения тепла и работы.
Если к рабочему телу подвести бесконечно малое (элементарное) количество тепла ёц, то состояние его изменится. При этом изменится температура, что приведет к изменению внутренней энергии на величину ёи. Также будет совершена работа, связанная с изменением объема рабочего тела, равная ё1.
Таким образом, вследствие подвода к рабочему телу тепла произошло изменение внутренней энергии и была совершена работа против внешних сил. На основании общего закона сохранения энергии можно написать: ёя = ёи + ё1. (1) Поскольку ё1 = рёу, то ёц = ёи + рёу. (2)
Уравнения (1) и (2) являются аналитическим выражением первого закона термодинамики в дифференциальной форме. Для конечного изменения состояния рабочего тела уравнение (2) нужно проинтегрировать: Я = Ли +1
Уравнению (2) можно придать другой вид, если воспользоваться понятием энтальпии - величина внутренней энергии и произведение давления системы на величину объёма системы. I = и + ру
.Вопрос 15.
Приведите аналитическое выражение второго закона термодинамики для обратимых и необратимых процессов в изолированной системе.
Ответ:
Под изолированной термодинамической системой принято понимать совокупность материальных тел, находящихся в энергетическом взаимодействии между собой, но отделенных от окружающей среды абсолютно нетеплопроводной оболочкой. В такой системе могут протекать различные термодинамические процессы без теплообмена с внешней средой (с1ц = 0).
2
Тогда из уравнения Аз = при условии с1ц = 0 следует, что если в изоли-
I Т
рованной системе протекают только обратимые процессы, то
аз =0
сист
а при протекании необратимых процессов
ЩЩ
Иначе говоря, энтропия изолированной системы при протекании в ней обратимых процессов не изменяется, а при протекании необратимых процессов - возрастает. Чем больше необратимость протекающих в системе процессов, тем больше возрастает энтропия. Таким образом, энтропия является мерой необратимости протекающих в изолированной системе процессов.
Вопрос 22.
Сформулируйте основной закон теплопроводности (закон Фурье) и приведите его математическое выражение. Что называется температурным градиентом и коэффициентом теплопроводности и как они определяются?
Ответ:
Предел отношения изменения температуры А1 к расстоянию между изотермами по нормали Ап называется градиентом температур и обозначается одним из следующих символов:
Иш(А1/Ап)Дп_>0 =д1/дп = §гас1 X = VI.
Температурный градиент является вектором, направленным по нормали к изотермической поверхности в сторону возрастания температуры, °С/м.
Фурье экспериментально установил, что количество переданной теплоты пропорционально падению температуры, времени и площади сечения, перпендикулярного направлению распространения теплоты. Если количество переданной теплоты отнести к единице площади сечения и единице времени, то установленную зависимость можно записать:
Я =-Х&гас11 (1)
Уравнение (1) является математическим выражением основного закона теплопроводности - закона Фурье. Этот закон лежит в основе всех теоретических и экспериментальных исследований процессов теплопроводности.
Коэффициент пропорциональности X в уравнении (1) называется коэффициентом теплопроводности. Он является физическим свойством вещества и характеризует его способность проводить теплоту
:I и II—| Вт/(м-° С). " ™
йгад I РтЛ1/1
Значение коэффициента теплопроводности представляет собой количество теплоты, которое проходит в единицу времени через единицу площади изотермической поверхности при температурном градиенте, равном единице.
Для различных веществ коэффициент теплопроводности Л различен и в общем случае зависит от структуры, плотности, влажности, давления и температуры.
ч.
V * I
сК п да |
|
|
|
|
|
|
|
Контрольная работа №2 Задача №9.
Определить энтальпию продуктов сгорания при коэффициенте избытка воздуха ат = 1, образовавшихся при полном сгорании 1 м3 природного газа состава: СО2 =0,2%; СН4 =98,2%, С2Н6=0,4%; С3Н8 = 0Д%; С4Н10 = ОД%; Ы2=1%, если известно, что температура газов на выходе из топки &г = 1100° С.
Решение:
Теоретически необходимый объём воздуха определяем по формуле: V0 = 0,0478[ОДСО + Н2) + 1,5Н28 + 2СН4 + 1(ш + п/4)СШНП - 02] =
= 0,0478(2 • 98,2 + 3,5 - 0,4 + 5 - 0,1 + 6,5 • ОД) = 9^1 м3 /м3. Объём трёхатомных газов по формуле: V = 0,01(С02 + СО + Н28 + 2>СШНП) =
= 0,01 • (0,2 + 98,2 + 2 • 0,4 + 3 • ОД + 4 • ОД) = 1 м3/м3. Теоретический объём азота по формуле: У°2 = 0,79V0 + N2 /100 = 0,79 - 9,51 +1 /100 = 7,52 м3 / м3. Теоретический объём водяных паров по формуле:
К2о =0,01[Н28 + Н2 + 1|СшНп + ОД 24ёг ] + 0,016 IVе =
= 0,01 • (2-98,2 + 3• 0,4 + 4• ОД + 5• ОД) + 0,0161 -9,51 = 2,13 м3/м\ Энтальпия продуктов сгорания при ат = 1 и = 1100°С по формуле: К = ^2(со)со2 + У2,(С1>)„, + У^(со)Н20 =
= 1 • 2457 7,52 -1545 + 2,13 • 1926 = 18178 кДж /кг.
где, (с1))ш =2457 кДж/м3 - энтальпия 1 м3 двуокиси углерода,
[6,табл.2]; ^^^Я^^Ш^^^ЯШШ^^^Ш
(ст>)к =1545 кДж/м3 - энтальпия 1 м3 азота, [6,табл.2];
(а)>м о -1926 кДж'м3 - энтальпия 1 и3 водяных паров, [6.табл.21;
Ответ: Н; =18178 кДж/кг.
Задача №15.
В топке котельного агрегата паропроизводителыюстью О = 3,9 кг/с сжигается природный газ состава:СО, =1Д%; СН4 =91,9%, С,Н*=24%; С5Н,=13%; С^НГ1) =0,4%; С5Н|е = 0,1%, М2 =3%. Определить расход натурального и условного топлива, если известны к.п.д. брутто котлоагрегата т}^ =89%, давление перегретого пара рвя =1,4 МПа, температура перегретого пара 1ЛЯ= 280°С, температура питательной воды = 100® С и величина непрерывной продувки р = 3%.
Решение:
Низшая теплота сгорания газообразного топлива:
<Х = 358СН4 + бЗЗСуЭе + 913С5Н, +1187С4НШ =
= 358 - 914* + 638-2Д +913-13+ 1187-0,4+ 1410-ОД=36043 кДж м3.
Натуральный расход топлива определим по формуле:
З^Ч2996-419)+(3/100)-(830Д-419) ? Ш
36,043-103 -0,89
где, Ьт = 29% кДж/кг — энтальпия перегретого пара по Ьэ-диаграмме;
Ьга =4491го =449-100=449 кДж/кг— энтальпия питательной воды: Ькв =8304 кДж/кг — энтадышя воды при рм, [5,табдЛ].
Расход условного топлива составит:
(V 36043
В__ =В——=03137 = 03859 м3/с=1389 м3/ч..
29300 29300
Ответ: В =03137 м5/с = 1129 м*/ч„ 8^=1389 м*/ч_
Задача Ле22.
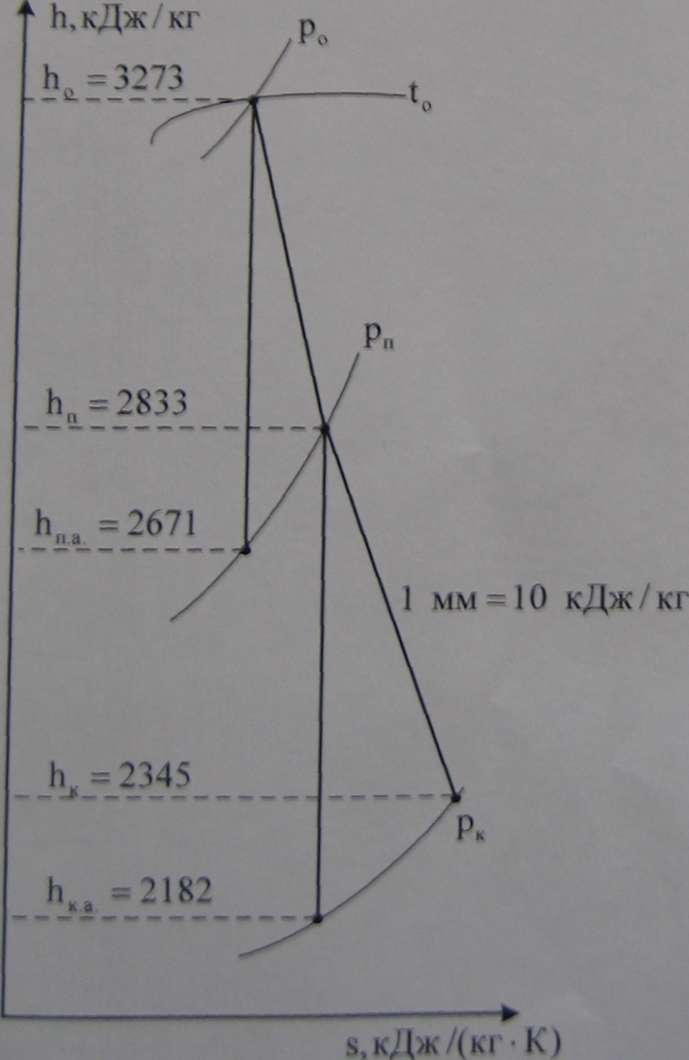
Конденсационная турбина с одним промежуточным отбором пара при давления г, = 03 МПа работает при начальных параметрах пара рг =4 МПа, !, = 425* С и давлении пара в конденсаторе р 4 = 4 кПа. Определить расход аш- ждаюшей воды для конденсатора турбины, если известны внутренний относительный кпд, части высокого давления (до отбора) 1ц = 0,73, внутренний относительный к п д, части низкого давления (после отбора) ц^ = 0,75. расход кмим- сирующегося пара = 7р кг //с, температура охлаждающей воды на входе в шцешзгор I, = 10* С и температура охлаждающей воды иа выходе из имаена- тора = 22* С. Изобразить прмтг расширения пара в турбине в Ь&- диаграмме.
Решение:
Энтальпию пара Ь„ нахатим по Ь&-диа<рамме
:Н0*3273 кДж/кг.
Энтальпию пара Ьпа и Ька находим, построив процесс адиабатного расширения пара на по Ьз-диаграмме от начального состояния до конечного: Ьм «2671 кДж/кг, Ька =2182 кДж/кг.
Энтальпию пара, поступающего из отбора, определим по формуле: Ьй » Ь0 - (Ь0 - Ь„„« 3273 - (3273 - 2671) . 0,73 = 2833 кДж / кг. Энтальпию пара в конденсаторе находим по формуле: Ьк = Нп - (Ьп - Нк а= 2833 - (2833 - 2182) • 0,75 = 2345 кДж / кг. Расход охлаждающей воды для конденсатора определим по формуле:
^ = ^//Ьк
7ЧЬ^ = 7,5'(2345~121>41)
= 331,7 кг/с,
(22-10). 4,19
где, Ьк = 121,41 кДж / кг - энтальпия конденсата отработавшего пара турбины в конденсаторе, [5, табл.11];
с, = 4,19 кДж/(кг • К) - теплоемкость воды.
Ответ: ^ = 331,7 кг/с.