
- •Механическое движение. Относительность движения. Равномерное и равноускоренное прямолинейное движение
- •Взаимодействие тел. Сила. Законы динамики
- •Импульс тела. Закон сохранения импульса. Проявление закона сохранения импульса в природе и его использование в технике.
- •Закон всемирного тяготения. Сила тяжести. Вес тела. Невесомость.
- •Превращения энергии при механических колебаниях. Свободные и вынужденные колебания. Резонанс.
- •Механические колебания.
- •Опытное обоснование основных положений молекулярно-кинетической теории строения вещества. Масса и размеры молекул
- •1. Относительная молекулярная масса.
- •2. Количество вещества и постоянная Авогадро.
- •3. Молярная масса.
- •Уравнение состояния идеального газа (уравнение Менделеева—Клапейрона). Изопроцессы.
- •1. Уравнение состояния. (Уравнение Менделеева – Клапейрона).
- •2. Газовые законы.
- •Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха. Измерение влажности воздуха
- •2. Кипение.
- •3. Влажность воздуха. Точка росы.
- •Кристаллические и аморфные тела. Упругие и пластические деформации твердых тел.
- •Кристаллические тела.
- •Аморфные тела.
- •Виды деформации твердых тел.
- •4. Механические свойства твердых тел.
- •Внутренняя энергия. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам. Адиабатный процесс
- •1. Внутренняя энергия.
- •2. Работа в термодинамике.
- •Взаимодействие заряженных тел. Закон Кулона. Закон сохранения электрического заряда.
- •1. Закон сохранения электрического заряда.
- •2. Закон Кулона.
- •Конденсаторы. Электроемкость конденсатора. Применение конденсаторов.
- •1. Конденсаторы.
- •2. Соединение конденсаторов в батарею.
- •3. Энергия заряженного конденсатора.
- •Работа и мощность в цепи постоянного тока. Электродвижущая сила. Закон Ома для полной цепи.
- •Э.Д.С. Источника электрической энергии.
- •2. Закон Ома для полной цепи.
- •3. Работа и мощность электрического тока.
- •4. Закон Джоуля – Ленца.
- •Магнитное поле. Действие магнитного поля на электрический заряд и опыты, подтверждающие это действие.
- •Магнитное поле.
- •2. Сила Лоренца.
- •Полупроводники. Собственная и примесная проводимость полупроводников. Полупроводниковые приборы.
- •4. Электрический ток в полупроводниках.
- •5. Электронно-дырочный переход.
- •6. Транзистор.
Опытное обоснование основных положений молекулярно-кинетической теории строения вещества. Масса и размеры молекул
В
Каждое утверждение
доказать опытным путем (привести
примеры)
вещество состоит из частиц;
эти частицы беспорядочно движутся;
частицы взаимодействуют друг с другом.
1. Относительная молекулярная масса.
Т.к. массы молекул
очень малы, то удобнее использовать в
расчетах не абсолютные значения масс,
а относительные. По международному
соглашению массы всех атомов и молекул
сравнивают с
![]() массы атома углерода.
массы атома углерода.
О
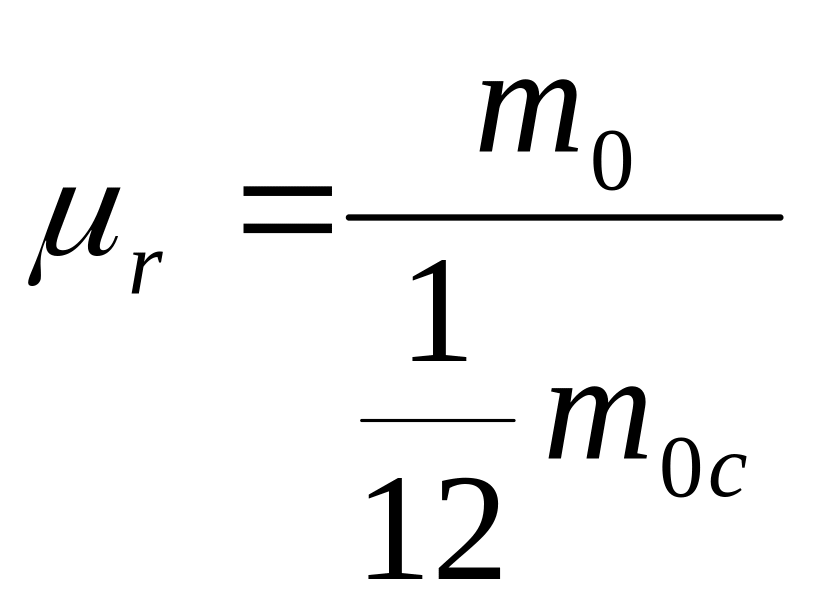
![]() называют
отношение массы молекулы (или атома) m0
данного вещества к
массы атома углерода m0c.
называют
отношение массы молекулы (или атома) m0
данного вещества к
массы атома углерода m0c.
![]()
Относительные атомные массы всех химических элементов точно измерены, их значение берем из таблицы Д.И.Менделеева.
2. Количество вещества и постоянная Авогадро.
Т.к. число молекул в любом теле очень велико, то в расчетах используют не абсолютное число молекул, а относительное. В Международной системе единиц количество вещества выражают в молях. (обозначение - ).
Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
NA - постоянная Авогадро - число атомов или молекул содержащееся в одном моле любого вещества.
NA=6*1023
моль-1.
Количество вещества равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в одном моле вещества.
![]()
![]()
3. Молярная масса.
Молярной массой вещества называют массу вещества, взятого в количестве одного моля. Тогда молярная масса вещества равна произведению массы молекулы на постоянную Авогадро.
=m0*N
![]()
где m0 – масса одной молекулы.
Формулы
![]() нельзя вывести, их надо запомнить.
нельзя вывести, их надо запомнить.
Все остальные формулы можно вывести. Например:
М
m=m0*N
Можно вывести следующее утверждение. Количество вещества равно отношению массы вещества к его молярной массе. (определение количества вещества из химии).

Уравнение состояния идеального газа (уравнение Менделеева—Клапейрона). Изопроцессы.
1. Уравнение состояния. (Уравнение Менделеева – Клапейрона).
Подставим в
уравнение P=nkT
выражение для концентрации молекул
газа. n=![]() Получим:
Получим:
![]() .
где k*NA=R.
.
где k*NA=R.
R=1,38*10-23Дж/К*6,02*1023моль-1=8,31![]() универсальна
газовая
универсальна
газовая
постоянная.
П
![]()
Уравнение Менделеева – Клапейрона.
У
![]()
2. Газовые законы.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
а) Изотермический процесс. (T=const). Закон Бойля – Мариотта
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
п
P1V1=P2V2=const
Для данной массы газа произведение давление газа на его
объем постоянно, если температура газа не меняется.
![]() .
Обратная зависимость между давлением
и температурой., График
.
Обратная зависимость между давлением
и температурой., График
b) Изобарный процесс. (P=const). Закон Ж. Гей-Люссака.
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Д
![]()
Данная зависимость графически изображается прямой, которая называется изобарой. График
с) Изохорный процесс. (V=const). Закон Шарля.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Д
![]()
Данная зависимость графически изображается прямой, которая называется изохорой. График.
