
- •Г.А.Масленникова курс лекций по органической химии
- •1 Функциональные производные карбоновых кислот
- •2 Галоидангидриды карбоновых кислот
- •Номенклатура
- •Химические свойства
- •3 Ангидриды карбоновых кислот
- •4 Сложные эфиры
- •Способы получения
- •Номенклатура
- •Физические свойства
- •Сложные эфиры
- •Химические свойства
- •Фруктовые эссенции
- •Жиры и масла
- •Значение и применение жиров и растительных масел
- •5 Амиды карбоновых кислот
- •Физические свойства
- •Химические свойства
- •6 Пероксиды ацилов. Надкислоты.
- •2 . Перекиси алкилов
- •С пособы получения
- •Химические свойства
- •3. Гидроперекиси алкилов
- •Химические свойства
- •8 Оксикислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •9 Оксокислоты
- •Номенклатура
- •Альдегидокислоты о бщая формула
- •К етокислоты
- •Реакции в кетонной форме
- •Реакции в енольной форме
- •Реакции, не имеющие ясного отношения к таутомерии
- •10 Нитросоединения
- •I Предельные мононитросоединения.
- •Номенклатура
- •Получение
- •Строение и свойства
- •Химические свойства
- •II. Полинитроалканы
- •I II. Ароматические нитросоединения
- •11 Амины
- •Классификация
- •Номенклатура
- •Физические свойства
- •Получение
- •С троение и основность
- •I. Алифатические амины
- •Химические свойства
- •4 Токсичных амина:
- •12 Диазосоединения
- •Соли диазония
- •15 Изонитрилы (изоцианиды) (карболамины)
- •Химические свойства
- •16 Элементоорганические соединения (э – с)
- •Методы получения
- •Магнийорганические соединения
- •Получение
- •Гриньяровских реактивов
- •Алюминийорганические соединения
- •Кремнийорганические соединения
- •Получение
- •Сероорганические соединения
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Нуклеофильное замещение
- •17 Гетероциклические соединения
- •Классификация
- •Номенклатура
- •Химические свойства
- •1. Химические свойства, в которых отличия:
- •2. Общие химические свойства
- •Пиридин
- •18 Углеводы (ув)
- •Номенклатура
- •Классификация
- •Углеводы
- •I. Моносахариды Некоторые способы получения моноз
- •Строение
- •Стереохимия моноз Оптическая Число ассиметрических атомов углерода в оксо-форме – 4
- •Пространственная
- •II Полисахариды (полиозы)
- •Список использованных источников
9 Оксокислоты
Или альдегидо- и кетокислоты – органические соединения, содержащие альдегидную (или кетонную) и карбоксильную группы.
Этот класс немногочисленен. Изучение их привело к важным результатам в биохимии и органический химии. Наибольшее значение имеют монооксокарбоновые кислоты.
Номенклатура
Рациональная. Альдегидо и кетокислоты можно рассматривать как производные соответствующих жирных кислот при замещении атома Н и радикале R на ацил. Ацилкарбоновая кислота.
Систематическая. Называются как карбоновая кислота с добавлением приставки оксо- и указанием номера атома углерода. (Оксогрупа = С = О).
Оксокислоты подразделяют на классы по признаку взаимного расположения функциональных групп, разделяя на -, - ,-оксокислоты.
Альдегидокислоты о бщая формула
Гомологический ряд начинается с глиоксиловой кислоты – (тривиальное название):
г лиоксалевая
кислота
лиоксалевая
кислота
формилмуравьная кислота
2-оксоэтановая
Это единственновозможная -альдегидокислота. Содержится в зелёных листьях и недозрелых плодах.
С ледующая
в ряду – формилуксусная кислота. В
свободном состоянии неизвестна:
ледующая
в ряду – формилуксусная кислота. В
свободном состоянии неизвестна:
3-оксопропановая кислота
Для альдегидокислот характерны все свойства альдегидов:
1) присоединение синильной кислоты НCN
2) присоединение бисульфита натрия NaSO3H
3) замещения карбонильного кислорода в реакции с гидроксиламином Н2N – ОН
4) с аммиачным раствором окиси серебра – реакция серебряного зеркала
по карбоксильной группе:
1) образование солей
2) образование сложных эфиров
С ильная
поляризация карбонильной группы под
влиянием карбоксильной делает возможной
реакцию Канниццаро:
ильная
поляризация карбонильной группы под
влиянием карбоксильной делает возможной
реакцию Канниццаро:
К етокислоты
Общая формула
-кетоокислоты
П ервой
в гомологическом ряду -кетокислот
является пировиноградная кислота:
ервой
в гомологическом ряду -кетокислот
является пировиноградная кислота:
Ацетилмуравьиная кислота
2-оксопропановая кислота
tпл = 14оС, tкип = 165оС
Промежуточный продукт при молочнокислом и спиртовом брожении углеводов.
Впервые выделена при пиролизе виноградной кислоты.
Соли – пируваты.
-кетокислоты гораздо сильнее тех карбоновых кислот, из которых их можно образовать
-оксокислоты - самые сильные из карбоновых кислот.

С* - ассиметрический атом углерода, он связан с четырьми различными группами.
НАД – никотинамидаадениндинуклеотид – никотинамидный кофермент
HSCoA – кофермент А, коэнзим А, пантетеинадениннуклеотиддифосфат. Содержится в растительных и животных тканях и в микроорганизмах. Акцептор и переносчик кислотных остатков при биохимическом окислительном декарбоксилировании кетокислот и др.
Ацетомуравьиная к-та сильнее уксусной кислоты, способна к енолизации:

Ацетомуравьиная кислота Пировиноградная
кислота
-оксокислоты
П ростейшая
из -
кетокислот – ацетоуксусная кислота
ростейшая
из -
кетокислот – ацетоуксусная кислота
которая, подобно другим - кетокислотам, отличается непрочностью.
Д екарбоксилирование
– общее свойство карбокислот:
екарбоксилирование
– общее свойство карбокислот:
in vivo:
Ацетоуксусная кислота образуется в процессе метаболизма высших жирных кислот, при окислении -окси масляной кислоты, накапливаетсяу диабетиков.
Н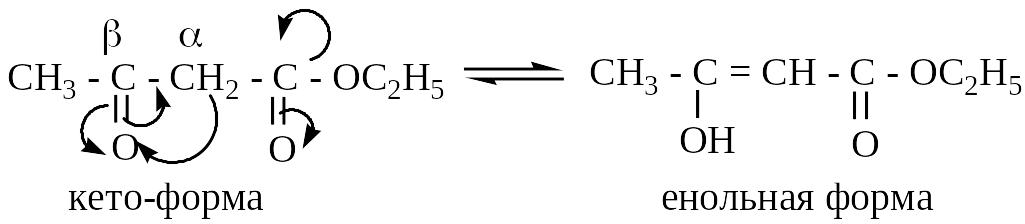 аибольший
интерес представляет ацетоуксусный
эфир (этиловый эфир ацетоуксусной
кислоты), который является смесью двух
взаимнопревращающихся изомеров:
таутомерные превращения:
аибольший
интерес представляет ацетоуксусный
эфир (этиловый эфир ацетоуксусной
кислоты), который является смесью двух
взаимнопревращающихся изомеров:
таутомерные превращения:
Положение равновесия зависит от температуры, природы растворителя, условий кислотного и основного катализа:
1) Энергетически более выгодна кето-форма. При перегонке из кварцевой посуды в отсутствие щелочи отгоняется более низкокипящая енольная форма, которая при стоянии постепенно переходит в равновесную смесь (содержание енольной формы менее 10%).
2) Вымораживанием, т.е. при охлаждении жидким воздухом раствора ацетауксусного эфира в петролейном эфире выкристаллизлвывается кето-форма с Tпл = - 39оС. Но при комнатной температур она вновь переходит в равновесную смесь.
3) влияние рН среды.
а) щелочная
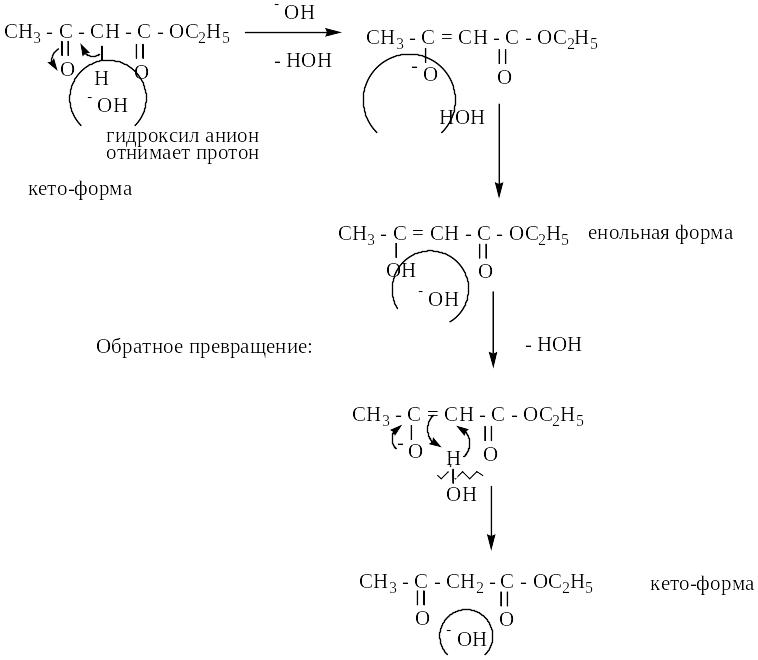

б) кислая
