
- •Г.А.Масленникова курс лекций по органической химии
- •1 Функциональные производные карбоновых кислот
- •2 Галоидангидриды карбоновых кислот
- •Номенклатура
- •Химические свойства
- •3 Ангидриды карбоновых кислот
- •4 Сложные эфиры
- •Способы получения
- •Номенклатура
- •Физические свойства
- •Сложные эфиры
- •Химические свойства
- •Фруктовые эссенции
- •Жиры и масла
- •Значение и применение жиров и растительных масел
- •5 Амиды карбоновых кислот
- •Физические свойства
- •Химические свойства
- •6 Пероксиды ацилов. Надкислоты.
- •2 . Перекиси алкилов
- •С пособы получения
- •Химические свойства
- •3. Гидроперекиси алкилов
- •Химические свойства
- •8 Оксикислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •9 Оксокислоты
- •Номенклатура
- •Альдегидокислоты о бщая формула
- •К етокислоты
- •Реакции в кетонной форме
- •Реакции в енольной форме
- •Реакции, не имеющие ясного отношения к таутомерии
- •10 Нитросоединения
- •I Предельные мононитросоединения.
- •Номенклатура
- •Получение
- •Строение и свойства
- •Химические свойства
- •II. Полинитроалканы
- •I II. Ароматические нитросоединения
- •11 Амины
- •Классификация
- •Номенклатура
- •Физические свойства
- •Получение
- •С троение и основность
- •I. Алифатические амины
- •Химические свойства
- •4 Токсичных амина:
- •12 Диазосоединения
- •Соли диазония
- •15 Изонитрилы (изоцианиды) (карболамины)
- •Химические свойства
- •16 Элементоорганические соединения (э – с)
- •Методы получения
- •Магнийорганические соединения
- •Получение
- •Гриньяровских реактивов
- •Алюминийорганические соединения
- •Кремнийорганические соединения
- •Получение
- •Сероорганические соединения
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Нуклеофильное замещение
- •17 Гетероциклические соединения
- •Классификация
- •Номенклатура
- •Химические свойства
- •1. Химические свойства, в которых отличия:
- •2. Общие химические свойства
- •Пиридин
- •18 Углеводы (ув)
- •Номенклатура
- •Классификация
- •Углеводы
- •I. Моносахариды Некоторые способы получения моноз
- •Строение
- •Стереохимия моноз Оптическая Число ассиметрических атомов углерода в оксо-форме – 4
- •Пространственная
- •II Полисахариды (полиозы)
- •Список использованных источников
8 Оксикислоты
Оксикислотами называются соединения, содержащие одновременно гидроксильные (одну или несколько) и карбоксильные группы. Часто оксикислоты называют как оксипроизводные карбоновых кислот (спиртокислоты)
Д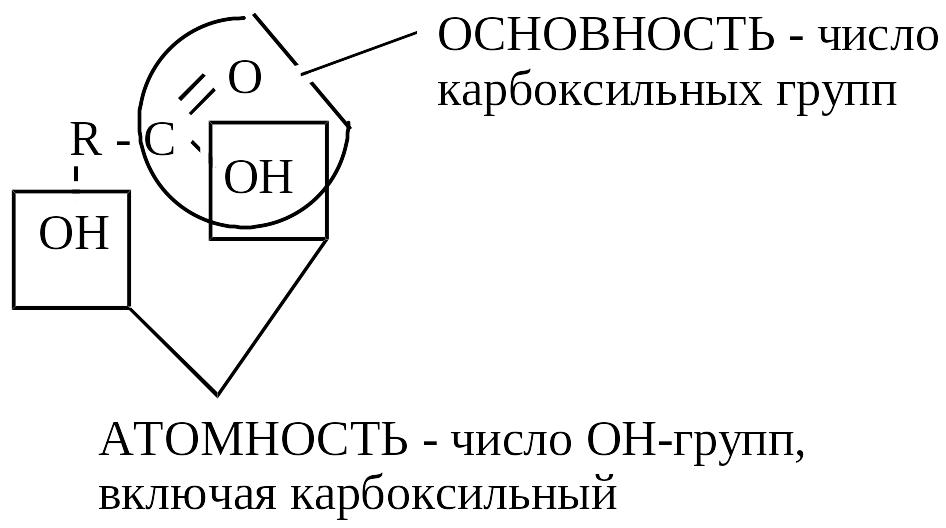 ля
оксикислот различают понятия основности
и атомности:
ля
оксикислот различают понятия основности
и атомности:
Номенклатура
Тривиальные названия образуются по природным источникам кислот: молочная кислота, яблочная кислота (оксиянтарная), винная (диоксиянтарная).
м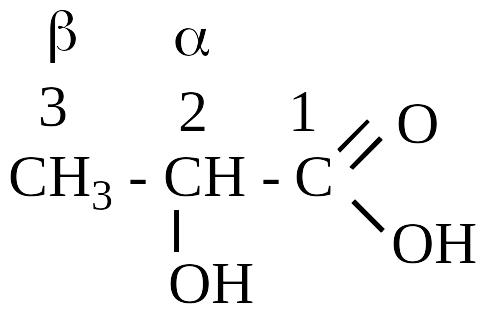 олочная
олочная
-оксипропионовая (рациональная)
2-оксипропановая (систематическая)
Систематические – от названия карбоновой кислоты с приставкой – окси. Нумерация начинается от карбоксильной группы.
О сновные
представители
сновные
представители
-
Гликолевая
(в соке незрелого винограда,
сахарного тростника)
Тпл = 79оС
Молочная (рацемат)
Тпл = 18оС Тпл = 26оС
(+) (-)
Соли – лактаты
L(+) молочная кислота выделена из мясного экстракта
Изомерия
1. Радикала: предельные, непредельные, ароматические
2. По основности: одноосновные, многоосновные
3. По расположению ОН-группы: у первичного, вторичного, третичного атома углерода.
4. По расположению ОН-группы относительно – СООН: -, -, - и т.д.
5. По наличию ассиметрического атома углерода – оптическая стереоизомерия.
Химические свойства
I – По карбоксиной группе
II – По ОН-группе
III – По –ОН и -СООН
IV – Особенности химических свойств
П о
сравнению с карбоновыми кислотами с
тем же числом углеродных атомов,
оксикислоты (в особенности -
кислоты) имеют более сильно выраженные
кислотные свойства
о
сравнению с карбоновыми кислотами с
тем же числом углеродных атомов,
оксикислоты (в особенности -
кислоты) имеют более сильно выраженные
кислотные свойства
При удалении спиртового радикала по молекулярной цепи его влияние практически не ощущается: -I- эффект затухает.
I. По -СООН
1 .
Образование солей
.
Образование солей
2 .
Образование сложных эфиров из солей
оксикислот
.
Образование сложных эфиров из солей
оксикислот

3 .
Образование хлорангидридов
.
Образование хлорангидридов
4 .
Оксикислоты не выдерживают сильного
нагревания, поэтому сложно получить
хлорангидриды и амиды оксикислот.
Единственный способ получения амидов
– аммонолиз сложных эфиров:
.
Оксикислоты не выдерживают сильного
нагревания, поэтому сложно получить
хлорангидриды и амиды оксикислот.
Единственный способ получения амидов
– аммонолиз сложных эфиров:
II. По –ОН -группе
1. Получение простых эфиров
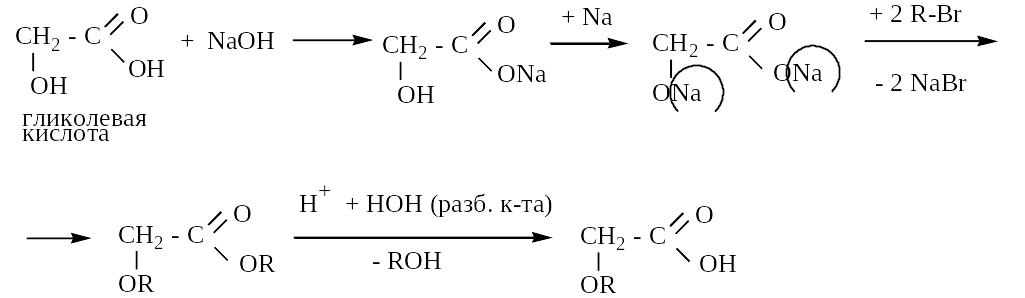
2. Взаимодействие с хлорангидридами

3. Действие галогенводородов
а) восстановление -оксикислот до предельных кислот йодистым водородом HI:
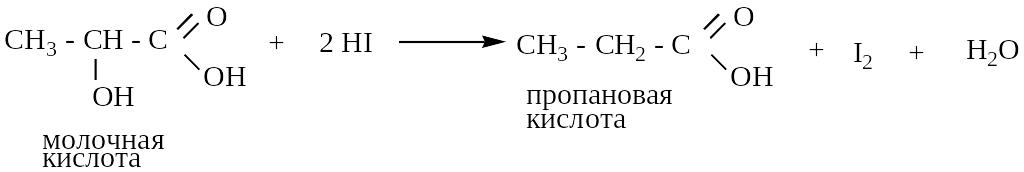
б) действие других HНal:

4. Окисление
а) – ОН – у первичного углерода – окисляется до альдегидокислоты
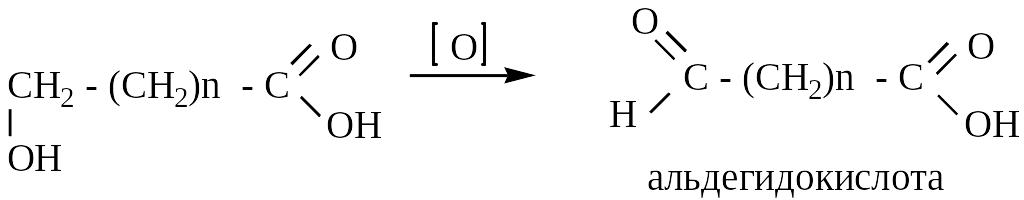
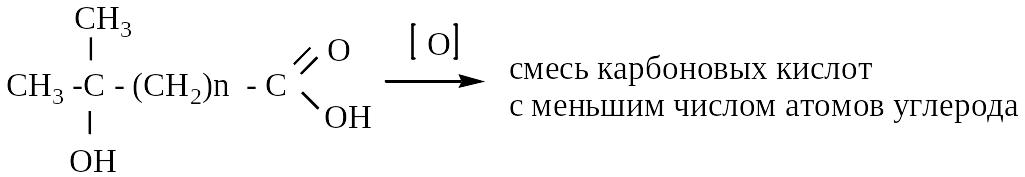
б) – ОН – у вторичного углерода – окисляется до кетокислоты
в )
– ОН – у третичного углерода – образуется
смесь карбоновых кислот с меньшим числом
атомов углерода
)
– ОН – у третичного углерода – образуется
смесь карбоновых кислот с меньшим числом
атомов углерода
III и IV
а) отношение к нагреванию.
Реакции отщепления позволяют получить -, -, - оксикислоты:
 -
оксикислоты:
-
оксикислоты:
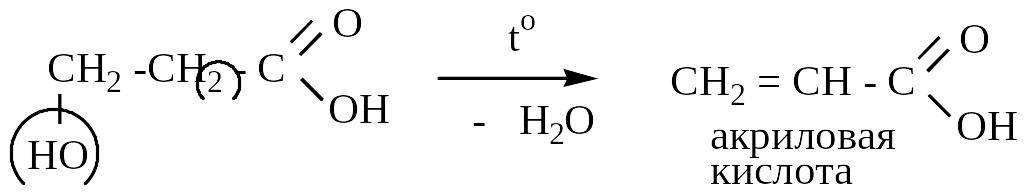 -
оксикислоты:
-
оксикислоты:

-, -, - оксикислоты:
б) Отношение к разбавленным минеральным кислотам
- оксикислоты распадаются на муравьиную кислоту и альдегиды (кислоты)
- ОН у вторичного атома углерода
-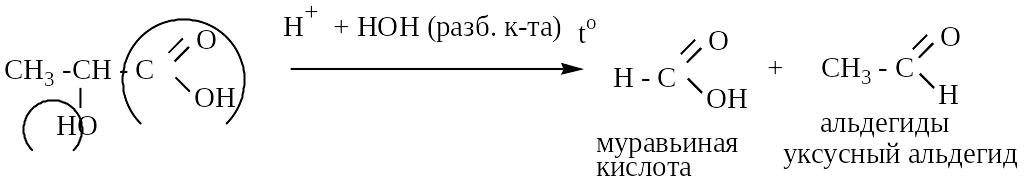 ОН у третичного атома углерода
ОН у третичного атома углерода
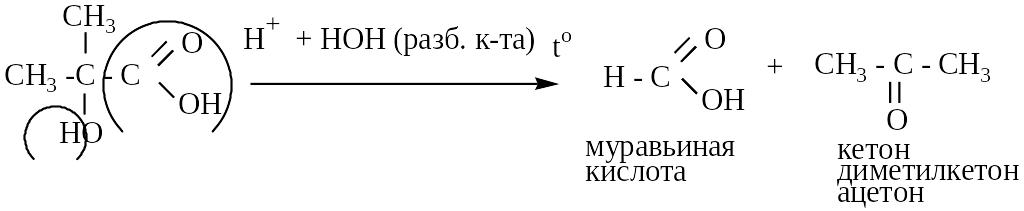
в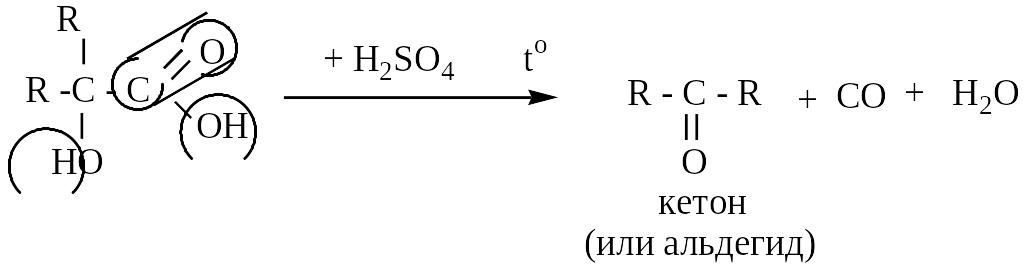 )
Отношение к концентрированным минеральным
кислотам:
)
Отношение к концентрированным минеральным
кислотам:
-оксикислоты:
