
- •Г.А.Масленникова курс лекций по органической химии
- •1 Функциональные производные карбоновых кислот
- •2 Галоидангидриды карбоновых кислот
- •Номенклатура
- •Химические свойства
- •3 Ангидриды карбоновых кислот
- •4 Сложные эфиры
- •Способы получения
- •Номенклатура
- •Физические свойства
- •Сложные эфиры
- •Химические свойства
- •Фруктовые эссенции
- •Жиры и масла
- •Значение и применение жиров и растительных масел
- •5 Амиды карбоновых кислот
- •Физические свойства
- •Химические свойства
- •6 Пероксиды ацилов. Надкислоты.
- •2 . Перекиси алкилов
- •С пособы получения
- •Химические свойства
- •3. Гидроперекиси алкилов
- •Химические свойства
- •8 Оксикислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •9 Оксокислоты
- •Номенклатура
- •Альдегидокислоты о бщая формула
- •К етокислоты
- •Реакции в кетонной форме
- •Реакции в енольной форме
- •Реакции, не имеющие ясного отношения к таутомерии
- •10 Нитросоединения
- •I Предельные мононитросоединения.
- •Номенклатура
- •Получение
- •Строение и свойства
- •Химические свойства
- •II. Полинитроалканы
- •I II. Ароматические нитросоединения
- •11 Амины
- •Классификация
- •Номенклатура
- •Физические свойства
- •Получение
- •С троение и основность
- •I. Алифатические амины
- •Химические свойства
- •4 Токсичных амина:
- •12 Диазосоединения
- •Соли диазония
- •15 Изонитрилы (изоцианиды) (карболамины)
- •Химические свойства
- •16 Элементоорганические соединения (э – с)
- •Методы получения
- •Магнийорганические соединения
- •Получение
- •Гриньяровских реактивов
- •Алюминийорганические соединения
- •Кремнийорганические соединения
- •Получение
- •Сероорганические соединения
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Нуклеофильное замещение
- •17 Гетероциклические соединения
- •Классификация
- •Номенклатура
- •Химические свойства
- •1. Химические свойства, в которых отличия:
- •2. Общие химические свойства
- •Пиридин
- •18 Углеводы (ув)
- •Номенклатура
- •Классификация
- •Углеводы
- •I. Моносахариды Некоторые способы получения моноз
- •Строение
- •Стереохимия моноз Оптическая Число ассиметрических атомов углерода в оксо-форме – 4
- •Пространственная
- •II Полисахариды (полиозы)
- •Список использованных источников
Химические свойства
Реакции с нуклеофильными реагентами.
Восстановление.
Реакции подвижного атома водорода в -положении по отношению к карбонильной группе
1. Реакции с нуклефильными реагентами (Н2О, ROH, NH3 и т.д.)
1.1. Гидролиз
1.1.1. Гидролиз в кислой среде
Гидролиз сложных эфиров активизируется кислотами за счет протонирования карбонильной группы, что приводит к усилению ее поляризации и повышению электрофльноости ключевого атома углерода:
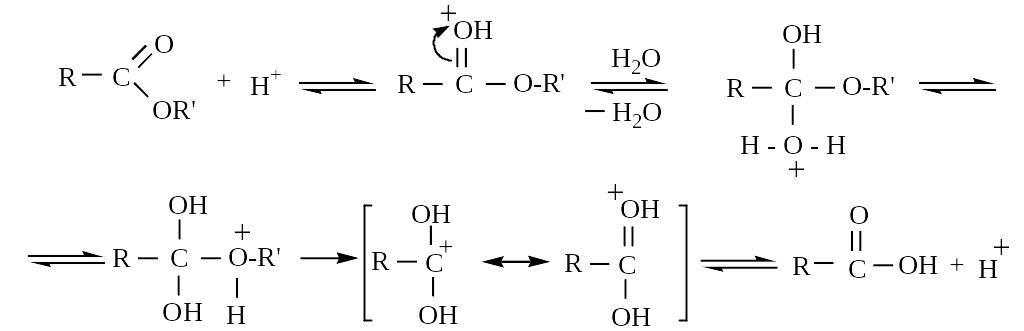
С точки зрения механизма гидролиз сложных эфиров аналогичен этерификации карбоновых кислот.
Основное условие полного гидролиза – избыток воды, что позволяет обеспечить необходимое смещение равновесия на соответствующих стадиях процесса /10/.
1.1.2. Гидролиз в щелочной среде.
И сторически
первым примером такой реакции было
щелочное расщепление эфиров высших
жирных кислот, что приводило к получению
мыла. Отсюда появился термин – «омыление»,
используемый и до сегодняшнего дня.
сторически
первым примером такой реакции было
щелочное расщепление эфиров высших
жирных кислот, что приводило к получению
мыла. Отсюда появился термин – «омыление»,
используемый и до сегодняшнего дня.
1.2. Переэтерификация.
Е сли
заменить воду на спирт (или другой
нуклеофил), то гидролиз не будет
происходить, а один эфир будет превращаться
в другой. Этот процесс называется
переэтерификацией.
сли
заменить воду на спирт (или другой
нуклеофил), то гидролиз не будет
происходить, а один эфир будет превращаться
в другой. Этот процесс называется
переэтерификацией.
1.2.1. Переэтерификация спиртами протекает и в кислой среде
Реакция ацилирования – введение в молекулу нуклеофила ацильного остатка.
Механизм аналогичен механизму гидролиза в кислой среде.
Оставить место – написать самостоятельно.
1.2.2. Переэтерификация спиртами в щелочной среде.
Здесь атакующий спирт под действием основания превращается в алкоксид-ион – более сильный нуклеофил:
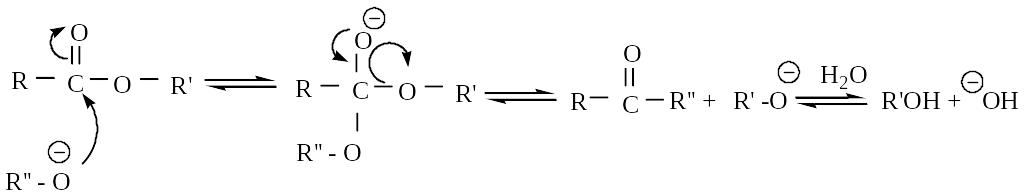
1.2.3. Переэтерификация кислотами.
1.2.4. Переэтерификация эфирами.
2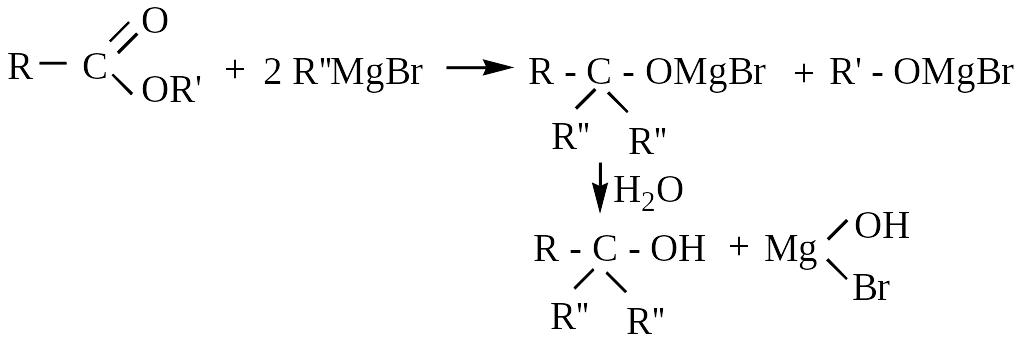 .
Примером восстановления является
реакция с реактивом Гриньяра, при этом
сложные эфиры образуют третичные спирты:
.
Примером восстановления является
реакция с реактивом Гриньяра, при этом
сложные эфиры образуют третичные спирты:
3. Сложноэфирная конденсация или конденсация Кляйзена.
Карбонильная группа сложных эфиров за счет -I – эффекта своего атома углерода и - - сопряжения придает кислотность - водородным атомам. Депротонирование сложных эфиров может осуществляться под действием алкоголятов:

О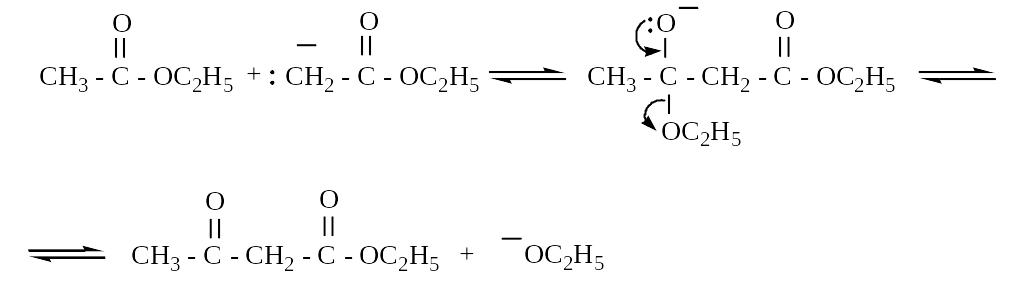 бразующийся
катион из-за своей нуклеофильности
атакует вторую молекулу сложного эфира;
при этом возникает связь С-С и образуется
оксоэфир:
бразующийся
катион из-за своей нуклеофильности
атакует вторую молекулу сложного эфира;
при этом возникает связь С-С и образуется
оксоэфир:
Реакция обратима: равновесие модно сдвинуть вправо путем отгонки образующегося этанола, что технически трудно. Поэтому применяют избыток этилата натрия, который реагирует с оксоэфиром и тем самым выводит его из равновесия.

Фруктовые эссенции
Летучие эфиры представляют собой жидкости с характерным фруктовым запахом. Неприятнопахнущие кислоты масляная и валериановая в результате этерификации превращаются в приятно пахнущие производные. Вкус и запах многих фруктов и цветов обуславливается присутствием в них смеси эфиров; искусственные цветочные эссенции представляют собой эмпирически подобранные смеси синтетических эфиров, воспроизводящие вкус и запах природных фруктов и экстрактов /9/.
Примеры сложных эфиров карбоновых кислот, имеющих фруктовый запах:
изобутилацетат СН3СООСН2СН(СН3)2 – имеет запах банана;
метилбутират С3Н7СООСН3 – имеет запах яблок;
этилбутират С3Н7СООС2Н5 – имеет запах ананасов;
изопентилбутират С3Н7СООС5Н11-изо , имеет запах груш; /9/
малиновая эссенция – при ее составлении используют 9 сложных эфиров, две органические кислоты (для придания кислого и терпкого вкуса), ацетальдегид, глицерин и спирт/4/.
Воски
Воски – сложные эфиры высших одноатомных спиртов с высшими одноосновными карбоновыми кислотами.
Пчелиный воск – нерастворимая в спирте часть состоит главным образом из эфира пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат, мирицин) С15Н31СООС31Н63 .
Кашалотный воск – твердый эфир пальмитиновой кислоты и цетилового спирта ( Т пл = 53,5оС ) (цетилпальмитат, спермацет) С15Н31СООС16Н33 .
Монтановый воск – эфир монтановой кислоты С27Н55СООН – экстрагируется из высушенного угля; при пиролизе этот воск переходит в смесь высших парафинов. Технический монтановый воск содержит смолы и размягчается в интервале 80-90оС /9/.
«Китайский воск» - в нем содержится много церотиново-церилового эфира СН3-(СН2)24-СО-О-СН2-(СН2)24-СН3.
