
- •Г.А.Масленникова курс лекций по органической химии
- •1 Функциональные производные карбоновых кислот
- •2 Галоидангидриды карбоновых кислот
- •Номенклатура
- •Химические свойства
- •3 Ангидриды карбоновых кислот
- •4 Сложные эфиры
- •Способы получения
- •Номенклатура
- •Физические свойства
- •Сложные эфиры
- •Химические свойства
- •Фруктовые эссенции
- •Жиры и масла
- •Значение и применение жиров и растительных масел
- •5 Амиды карбоновых кислот
- •Физические свойства
- •Химические свойства
- •6 Пероксиды ацилов. Надкислоты.
- •2 . Перекиси алкилов
- •С пособы получения
- •Химические свойства
- •3. Гидроперекиси алкилов
- •Химические свойства
- •8 Оксикислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •9 Оксокислоты
- •Номенклатура
- •Альдегидокислоты о бщая формула
- •К етокислоты
- •Реакции в кетонной форме
- •Реакции в енольной форме
- •Реакции, не имеющие ясного отношения к таутомерии
- •10 Нитросоединения
- •I Предельные мононитросоединения.
- •Номенклатура
- •Получение
- •Строение и свойства
- •Химические свойства
- •II. Полинитроалканы
- •I II. Ароматические нитросоединения
- •11 Амины
- •Классификация
- •Номенклатура
- •Физические свойства
- •Получение
- •С троение и основность
- •I. Алифатические амины
- •Химические свойства
- •4 Токсичных амина:
- •12 Диазосоединения
- •Соли диазония
- •15 Изонитрилы (изоцианиды) (карболамины)
- •Химические свойства
- •16 Элементоорганические соединения (э – с)
- •Методы получения
- •Магнийорганические соединения
- •Получение
- •Гриньяровских реактивов
- •Алюминийорганические соединения
- •Кремнийорганические соединения
- •Получение
- •Сероорганические соединения
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Нуклеофильное замещение
- •17 Гетероциклические соединения
- •Классификация
- •Номенклатура
- •Химические свойства
- •1. Химические свойства, в которых отличия:
- •2. Общие химические свойства
- •Пиридин
- •18 Углеводы (ув)
- •Номенклатура
- •Классификация
- •Углеводы
- •I. Моносахариды Некоторые способы получения моноз
- •Строение
- •Стереохимия моноз Оптическая Число ассиметрических атомов углерода в оксо-форме – 4
- •Пространственная
- •II Полисахариды (полиозы)
- •Список использованных источников
Способы получения
1. Этерификация по Фишеру – наиболее применяемый.
В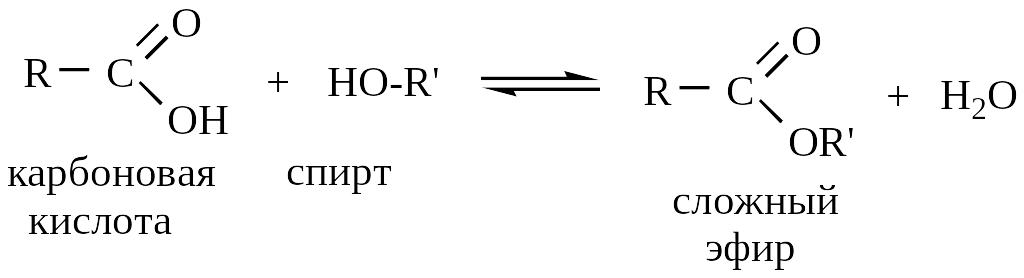 присутствии сильной кислоты (например,
серной) карбоновые кислоты дают со
спиртами сложные эфиры:
присутствии сильной кислоты (например,
серной) карбоновые кислоты дают со
спиртами сложные эфиры:
Скорость реакции эфирообразования зависит от строения спиртов и кислот. Кислоты строения R-CH2-COOH скорее вступают в реакцию, чем кислоты строения R2CH-COOH и R3C-COOH /7/.
Реакционная способность спиртов понижается в ряду: первичный вторичный третичный /6/.
Эфирообразование – сложный процесс; изучение его кинетики позволило выявить несколько различных путей, по которым он может идти. Здесь рассматривается механизм, по-видимому, относящийся к большинству случаев.
Роль катализаторов в реакции этерификации играют ионы водорода. Кислород карбонильной группы кислоты, захватывая протон, образует карбониевый ион :
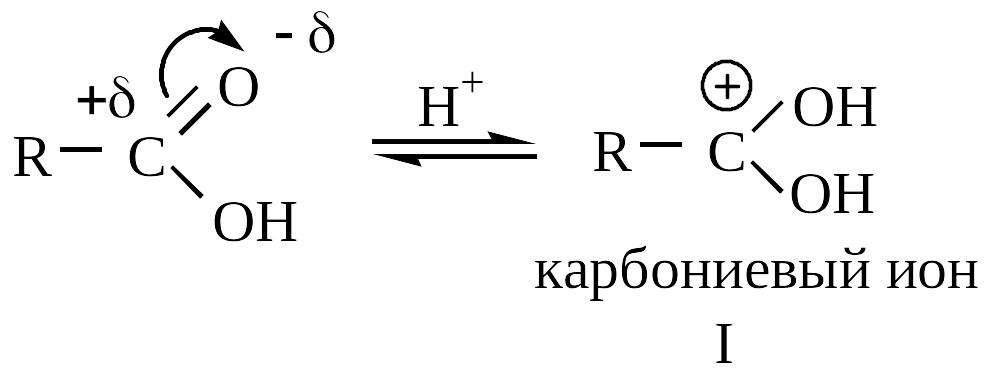
С оединение
I
присоединяет молекулу спирта за счет
неподеленных электронов кислородного
атома с образованием промежуточного
комплекса II:
оединение
I
присоединяет молекулу спирта за счет
неподеленных электронов кислородного
атома с образованием промежуточного
комплекса II:
Комплекс II способен обратимо распадаться с отщеплением воды и образованием нового карбониевого катиона сложного эфира III:

который при диссоциации образует сложный эфир, причем освобождается катализатор – протон /7/.
С помощью «меченых атомов» (тяжёлого изотопа кислорода О18) было показано, что вода при этерификации образуется за счет водорода спирта и гидроксила кислоты:
Т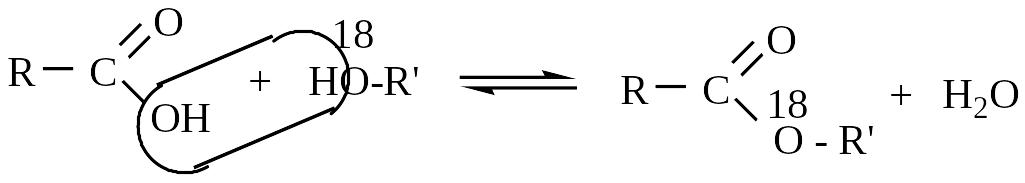 .к.
меченый кислород находится в спирте,
то образующаяся при этерификации вода
содержит только обычный кислород. Вода,
образующаяся при сожжении эфира, содержит
О18/7/.
.к.
меченый кислород находится в спирте,
то образующаяся при этерификации вода
содержит только обычный кислород. Вода,
образующаяся при сожжении эфира, содержит
О18/7/.
Сложные эфиры третичных спиртов и карбоновых кислот прямой этерификацией получить нельзя.
2. Из галогенангидридов и спиртов или фенолов
3. Из ангидридов кислот и спиртов или фенолов.
4. Из кетенов и спиртов или фенолов.
5. Из серебряных или калиевых солей кислот и алифатических галоидных производных.
6. Из свободных кислот и алифатических диазосоединений, главным образом диазометана.
7. Присоединением органических кислот к алкенам (главным образом к высшим алкенам) под каталитическим действием серной кислоты или фтористого бора.
8. Из альдегидов под влиянием этилата алюминия /3/.
Номенклатура
Названия сложных эфиров образуют от названия спиртового радикала в качестве приставки и названия кислоты, в котором окончания –овая заменяется на –оат /7/:

Физические свойства
Сложные эфиры жирных кислот и предельных спиртов – жидкости, обладающие приятным фруктовым запахом. Они употребляются для отдушки с освежающим фруктовым запахом. Лишь простейшие из них несколько растворимы в воде. Метиловые и этиловые сложные эфиры кипят при более низких температурах, чем соответствующие кислоты.
Таблица
Сложные эфиры
Кислота |
Метиловые эфиры |
Этиловые эфиры |
||||
Т пл, оС |
Т кип, оС |
|
Т пл, оС |
Т кип, оС |
|
|
Муравьиная (Ткип= + 100,5оС) |
- 99,0 |
+ 31,8 |
0,975 |
- 78,9 |
+ 54,3 |
0,923 |
Уксусная (Ткип= + 118,5оС) |
-98,1 |
+ 57,0 |
0,934 |
- 83,4 |
+ 77,2 |
0,901 |
Пропионовая (Ткип= + 141,1оС) |
- 87,5 |
+ 80,6 |
0,915 |
-73,9 |
+ 99,1 |
0,888 |
