
- •Г.А.Масленникова курс лекций по органической химии
- •1 Функциональные производные карбоновых кислот
- •2 Галоидангидриды карбоновых кислот
- •Номенклатура
- •Химические свойства
- •3 Ангидриды карбоновых кислот
- •4 Сложные эфиры
- •Способы получения
- •Номенклатура
- •Физические свойства
- •Сложные эфиры
- •Химические свойства
- •Фруктовые эссенции
- •Жиры и масла
- •Значение и применение жиров и растительных масел
- •5 Амиды карбоновых кислот
- •Физические свойства
- •Химические свойства
- •6 Пероксиды ацилов. Надкислоты.
- •2 . Перекиси алкилов
- •С пособы получения
- •Химические свойства
- •3. Гидроперекиси алкилов
- •Химические свойства
- •8 Оксикислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •9 Оксокислоты
- •Номенклатура
- •Альдегидокислоты о бщая формула
- •К етокислоты
- •Реакции в кетонной форме
- •Реакции в енольной форме
- •Реакции, не имеющие ясного отношения к таутомерии
- •10 Нитросоединения
- •I Предельные мононитросоединения.
- •Номенклатура
- •Получение
- •Строение и свойства
- •Химические свойства
- •II. Полинитроалканы
- •I II. Ароматические нитросоединения
- •11 Амины
- •Классификация
- •Номенклатура
- •Физические свойства
- •Получение
- •С троение и основность
- •I. Алифатические амины
- •Химические свойства
- •4 Токсичных амина:
- •12 Диазосоединения
- •Соли диазония
- •15 Изонитрилы (изоцианиды) (карболамины)
- •Химические свойства
- •16 Элементоорганические соединения (э – с)
- •Методы получения
- •Магнийорганические соединения
- •Получение
- •Гриньяровских реактивов
- •Алюминийорганические соединения
- •Кремнийорганические соединения
- •Получение
- •Сероорганические соединения
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •Применение
- •Физические свойства
- •Химические свойства
- •Нуклеофильное замещение
- •17 Гетероциклические соединения
- •Классификация
- •Номенклатура
- •Химические свойства
- •1. Химические свойства, в которых отличия:
- •2. Общие химические свойства
- •Пиридин
- •18 Углеводы (ув)
- •Номенклатура
- •Классификация
- •Углеводы
- •I. Моносахариды Некоторые способы получения моноз
- •Строение
- •Стереохимия моноз Оптическая Число ассиметрических атомов углерода в оксо-форме – 4
- •Пространственная
- •II Полисахариды (полиозы)
- •Список использованных источников
4 Токсичных амина:
а) мускарин –третичный амин, содержится в красном мухоморе
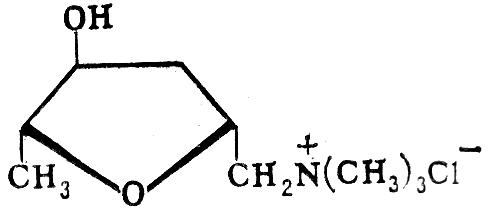
б) 1,4-тетраметилендиамин; 1,4-диаминобутан; путресцин
H2N –(CH2)4 – NH2
Имеет неприятный запах гниющего тела
Putrescence – гниение.
в) 1,5 – пентаметилендиамин; 1,5-диаминопентан; кадаверин
H2N –(CH2)5 – NH2 (трупный яд)
Содержится в продуктах гнилостного распада белков; найден в спорынье, мухоморе, сыре, пивных дрожжах.
г) кокаин; 2-карбометокси-3-бензоилокситропан
А лкалоид,
содержится в листьях кустарника кока,
произрастающего в Южной Америке.
лкалоид,
содержится в листьях кустарника кока,
произрастающего в Южной Америке.
Первоначально использовали как местное анестезирующее средство.
Наркотик – проблема - кокаинизм.
Алкалоиды – гетероциклические азотсодержащие основания растительного происхождения, обладающие выраженным физиологическим действием.
С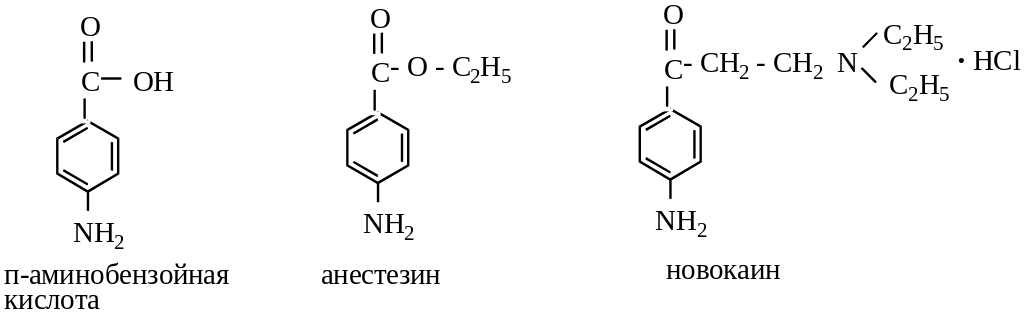 интетические
аналоги кокаина, лишенные наркотических
свойств, относятся к производным
п-аминобензойной
кислоты:
интетические
аналоги кокаина, лишенные наркотических
свойств, относятся к производным
п-аминобензойной
кислоты:
12 Диазосоединения
Э![]() то
соединения, содержащие азо-группу , в
которой только один атом азота связан
с углеводородным радикалом (алифатическим
или ароматическим)
то
соединения, содержащие азо-группу , в
которой только один атом азота связан
с углеводородным радикалом (алифатическим
или ароматическим)
Основные типы диазосоединений:
1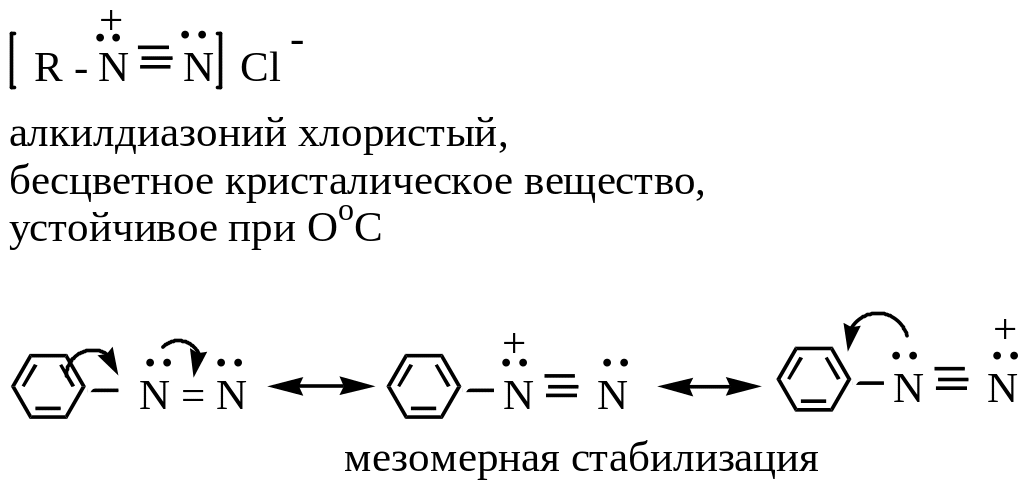 )
соли диазония
)
соли диазония
2) диазогидраты и диазотаты
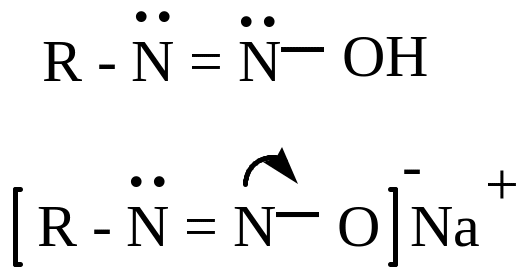
3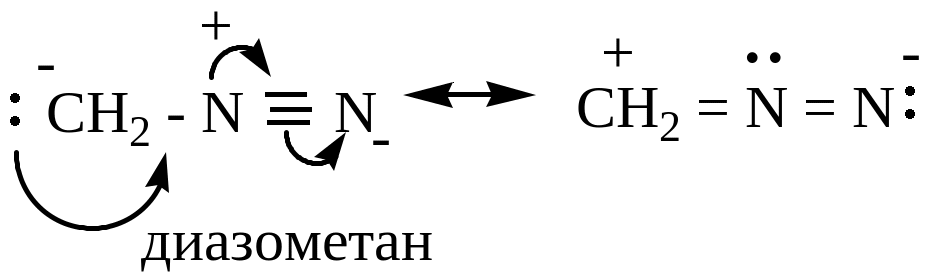 )
диазоалканы (диазометан) ядовитый газ,
разлагается при обычной температуре
со взрывом; более устойчив в растворе
в эфире
)
диазоалканы (диазометан) ядовитый газ,
разлагается при обычной температуре
со взрывом; более устойчив в растворе
в эфире
доказано, что молекула линейна
Соли диазония
Образуются при взаимодействии ароматических аминов с азотистой кислотой в кислой среде. Эта реакция называется реакцией диазотирования:
Д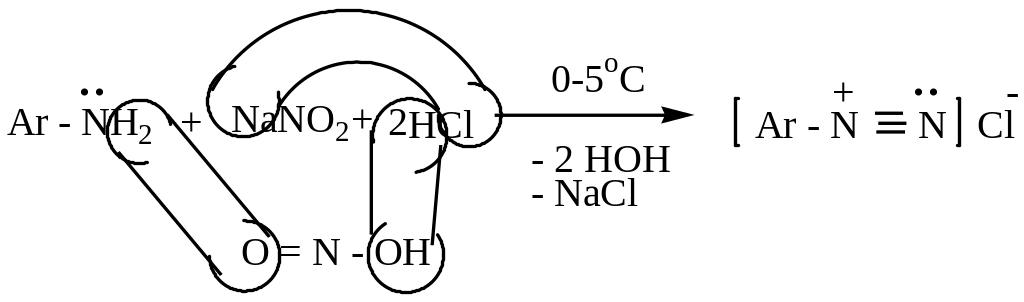 ля
получения азотистой кислоты можно
использовать:
ля
получения азотистой кислоты можно
использовать:
а )
Н2SO4
конц.
)
Н2SO4
конц.
Нитрит сернокислый
Натрия кислый натрий
серная
кислота
б) Н2SO4 средней конц.
N aNO2
+ H2SO4
= HNO2
+ NaHSO4
aNO2
+ H2SO4
= HNO2
+ NaHSO4
в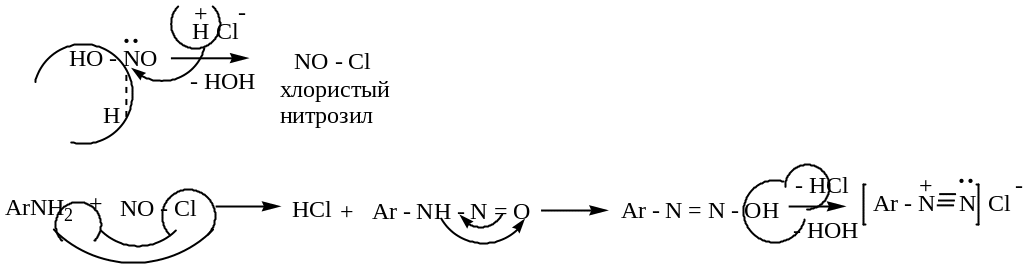 )
HCl или
HBr
)
HCl или
HBr
NaNO2 + HCl = HNO2 + NaCl
г )
щелочная среда
)
щелочная среда
в щелочной среде соли диазония образуют гидрат диазония:
Д иазотаты,
диазоцианиды и другие подобные вещества
с группировкой – N
= N
– могут существовать в двух формах –
син-
и анти-
:
иазотаты,
диазоцианиды и другие подобные вещества
с группировкой – N
= N
– могут существовать в двух формах –
син-
и анти-
:
Побочные реакции диазотирования:
а) в нейтральной или слабокислой среде
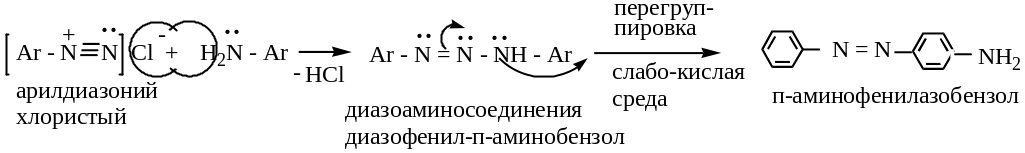
б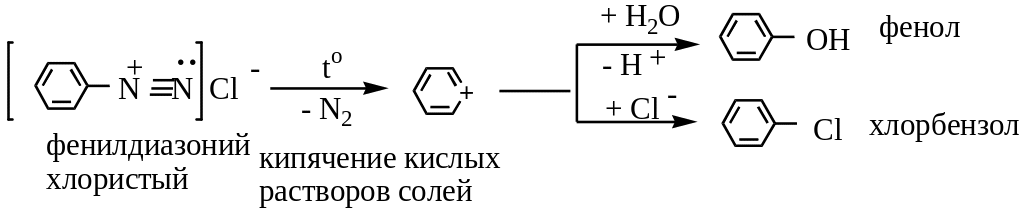 )
несоблюдение температурных условий
)
несоблюдение температурных условий
Реакции солей диазония могут проходить:
I - с выделением азота
II - без выделения азота
I - с выделением азота
- с выделением азота
1) Нагревание слей диазония в отсутствие растворимых солей:
2) При действии иодида калия получают арилиодиды (арилхлориды и арилбромиды в этих условиях не образуются):
3
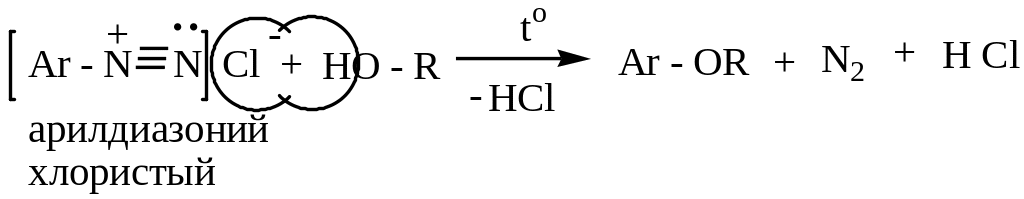 )
)
4) Замещение диазогруппы на другие атомы или группы атомов происходит в присутствие соответствующих солей меди или медного порошка: (реакция Зандмейера):
5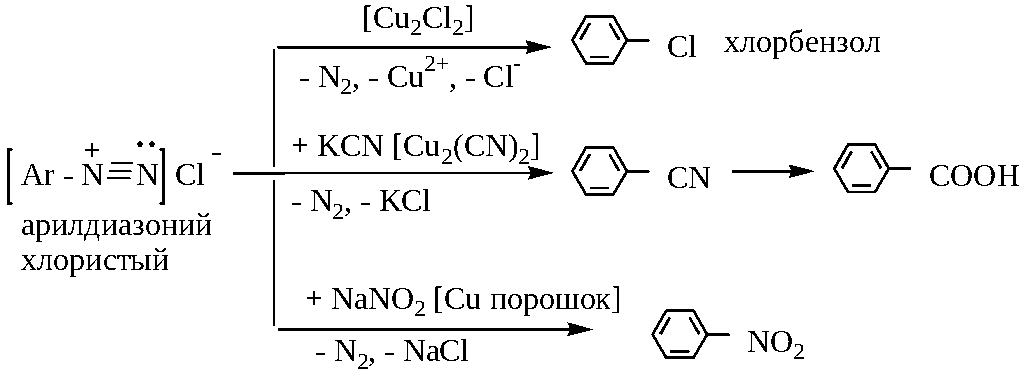 )
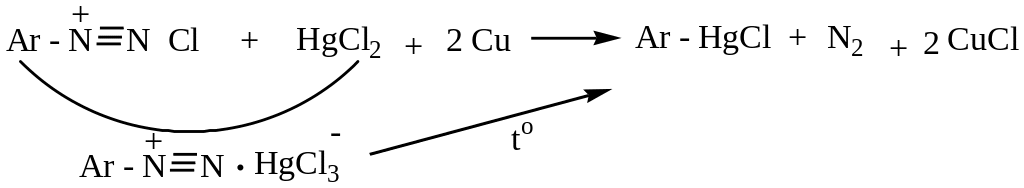
Александр Николаевич Несмеянов разработал
метод получения металлоорганических
соединений (ртутноорганических):
)
Александр Николаевич Несмеянов разработал
метод получения металлоорганических
соединений (ртутноорганических):
II – без выделения азота (амфотерные свойства)
1)
2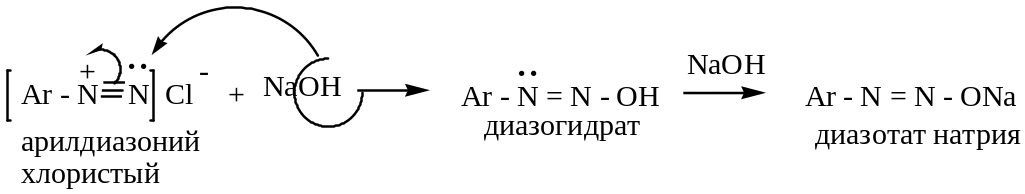
 )
реакция восстановления в фенилгидразин
)
реакция восстановления в фенилгидразин
восстановление солями сернистой кислоты (промышленный способ):
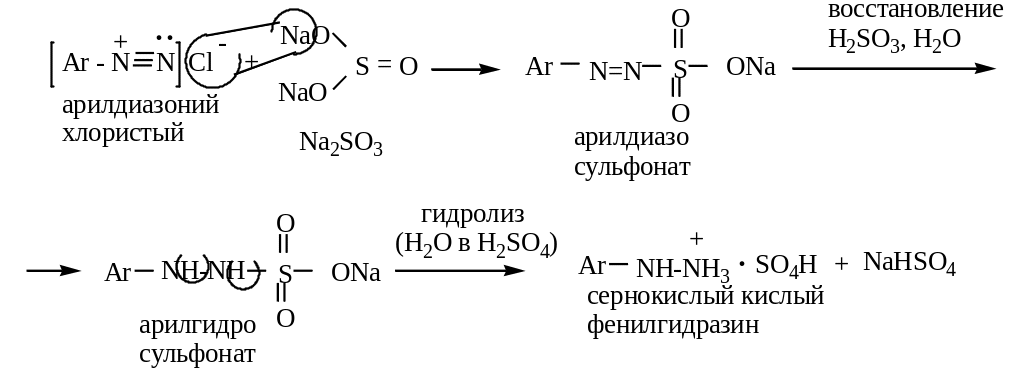
3 )
реакции азосочетания – это реакции
электрофильного замещения в ядре фенол
(нафтола) или ароматического амина.
)
реакции азосочетания – это реакции
электрофильного замещения в ядре фенол
(нафтола) или ароматического амина.
В -комплексе один атом углерода пребывает в состоянии sp3-гибридизации, а второй (формально лишившийся -связи) приобретает вакантную орбиталь (+). Сопряжение последней с оставшимися четырьмя -электронами приводит к делокализации и, следовательно, стабилизации положительного заряда. Образовавшийся таким образом циклогексадиенильный катион отщепляет протон (от атома углерода в sp3-состоянии) и снова превращается в устойчивую ароматическую систему.
Замещение идет в п-положение, и если оно занято, то в о-положение.
При замещении в п-положение возникает более длинная цепь сопряжения в продукте реакции, и оно является более устойчивым.
Электофильным реагентом является диазокатион. Другие формы диазосоединений в этой реакции не участвуют.
В случае первичных и вторичных ароматических аминов в слабокислой среде азогруппа идет не в ядро, а в аминогруппу:
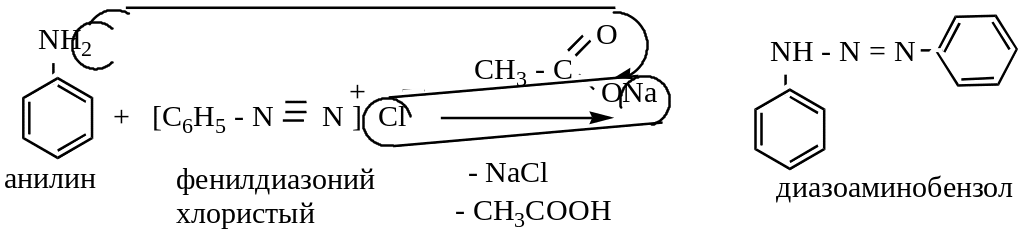
Реакция широко используется в технике для приготовления азокрасителей.
Процесс состоит из
а )
диазотирования – взаимодействие аминов
с азотистой кислотой в кислой среде с
образованием активного реагента
диазокатиона:
)
диазотирования – взаимодействие аминов
с азотистой кислотой в кислой среде с
образованием активного реагента
диазокатиона:
б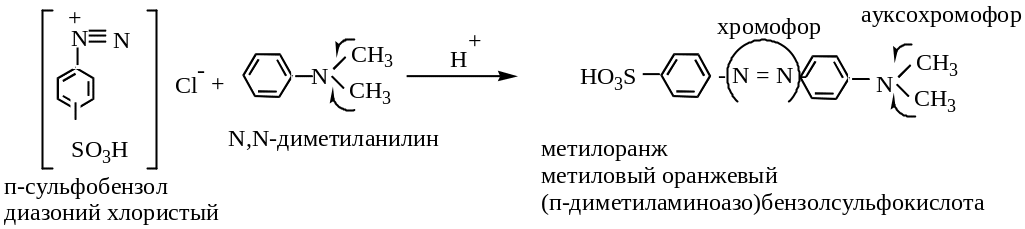 )
азосоченание
)
азосоченание
13 Азосоединения
Это соединения содержащие азогруппу ( ), которая соединена с двумя углеводородными радикалами.
В зависимости от природы радикала:
-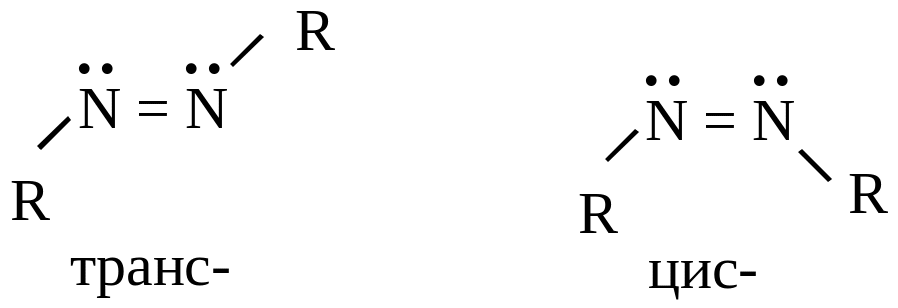 азоалканы
азоалканы
-![]() азоарены
азоарены
Номенклатура
1 )
Если R
одинаковы, то дается название углеводорода
(по R)
и префикс –азо.
)
Если R
одинаковы, то дается название углеводорода
(по R)
и префикс –азо.
2 )
если R
неодинаковы:
)
если R
неодинаковы:
Азоалканы
Э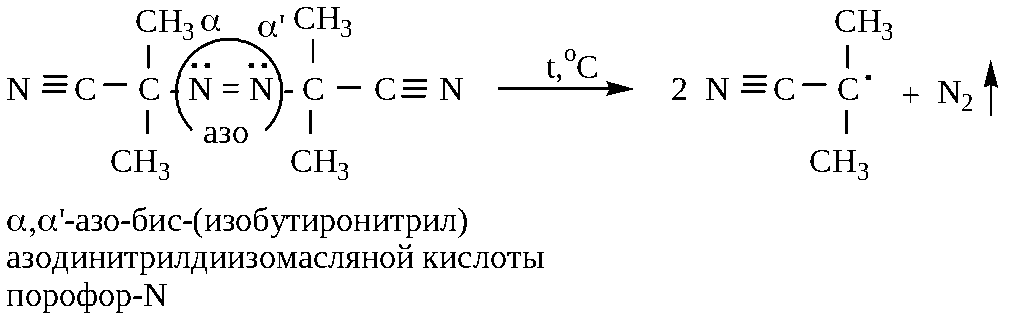 то
очень нестабильные, желто-оранжевые
(желто-красные) вещества, разлагаются
при хранении, при нагревании разлагаются
со взрывом
то
очень нестабильные, желто-оранжевые
(желто-красные) вещества, разлагаются
при хранении, при нагревании разлагаются
со взрывом
Инициатор радикальной полимеризации.
Азоарены
Это уже стабильные соединения благодаря системе сопряжения электронов атомов азота и ядра (причем стабильны транс-изомеры, цис- также нестабильны).
Э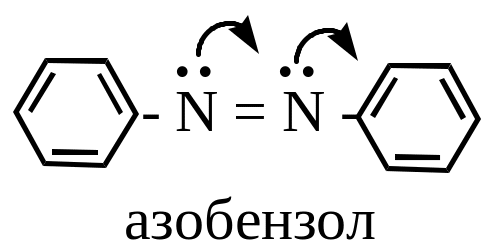 то
слабые основания.
то
слабые основания.
От азобензола производится важный класс азорасителей. Их окраска обусловлена наличием группы – N = N -, являющейся хромофорной группой.
Цвет органических соединений тесно связан с их строением. Согласно теории цветности окраска соединений объясняется наличием в молекулах этих соединений ненасыщенных групп атомов, называемых хромофорами или хромофорными группами. Хромофоры поглощают свет в видимой области, возбуждая -электроны своих кратных связей, что вызывает ощущение цвета человеческим глазом. Важнейшие хромофоры:
-![]() метиновая
группа = СН -, особенно, если она входит
в состав хиноидной группировки:
метиновая
группа = СН -, особенно, если она входит
в состав хиноидной группировки:
- азометиновая – СН = N -
- азогруппа -N = N -
- карбонильная группа =C = O
- нитрозогруппа -N = O
- нитрогруппа – NO2
Интенсивность окраски соединений объясняется наличием в молекулах красителей электронодонорных групп, называемых ауксохромами, или ауксохромными группировками. Эти же группы обычно обусловливают способность красителей связываться с волокнами окрашиваемого материала. Без наличия такого сродства к материалу окрашенное вещество не является красителем. Важнейшие ауксохромы: -ОН, - NH2, -OR, -NR2, -SH, -NHR.
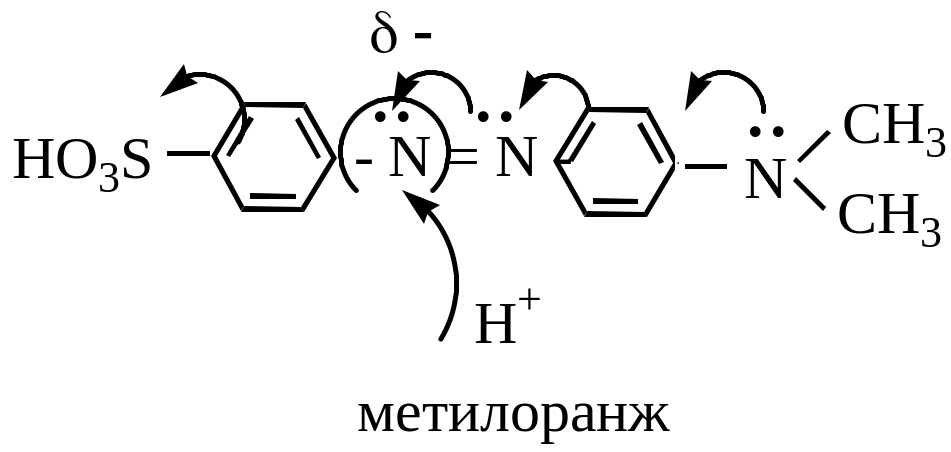
Введение электронодонорных групп резко увеличивает основность атома азота и азогруппа способна протонироваться, при этом происходит углубление цвета
Желтый оранжевый
Красный синий
Сульфогруппа – для увеличения растворимости.
14 Нитрилы
Общая формула R – C N
Можно рассматривать как алкильные или арильные производные синильной кислоты и называются также алкил- или арилцианидами. Их можно рассматривать как производные соответствующих карбоновых кислот и название образуется из тривиального названия кислоты + суффикс –нитрил.
СH3 – C N C6H5C N
ацетонитрил бензонитрил
Физические свойства
Низшие нитрилы – бесцветные жидкости, растворимые в воде, ядовиты меньше, чем синильная кислота (ПДК = 0,3 мг/л, 50-60 мг смертельная доза, при более высоких концентрациях не спасает даже противогаз, т.к. всасывание идет через кожу).
Классификация
по природе радикала;
по числу –CN (моно-, поли-)
Химические свойства
1. Гидролиз (нуклеофильное присоединение)
а) кислотный
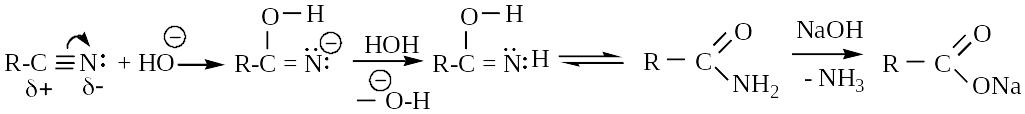
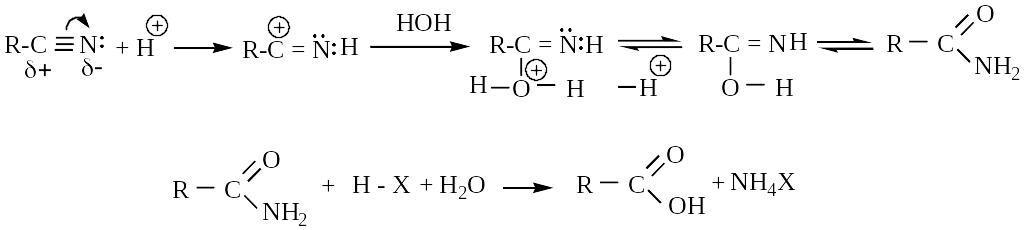
б) щелочной
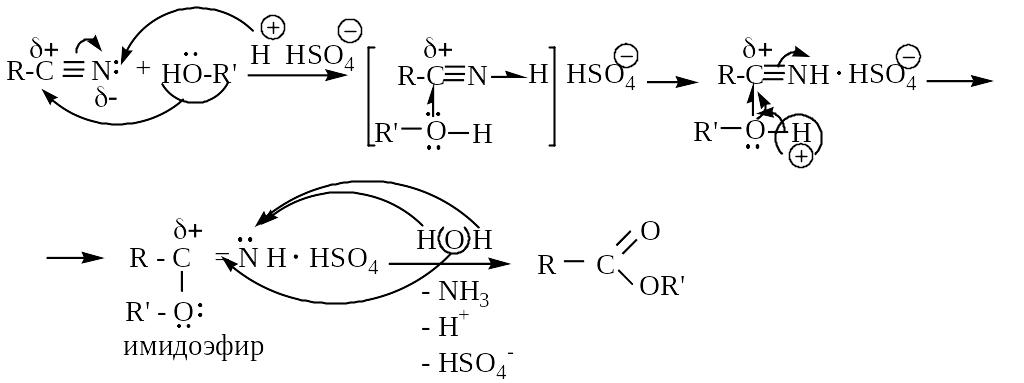
2. Этерификация (в кислой и щелочной среде нитрилы взаимодействуют с водой и спиртами):
3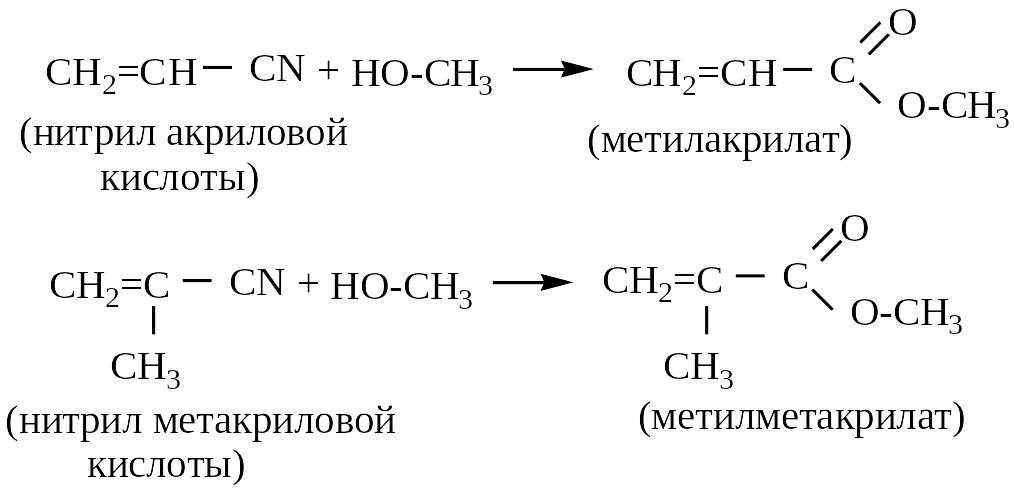 .
Полимеризация акрилонитрила
.
Полимеризация акрилонитрила
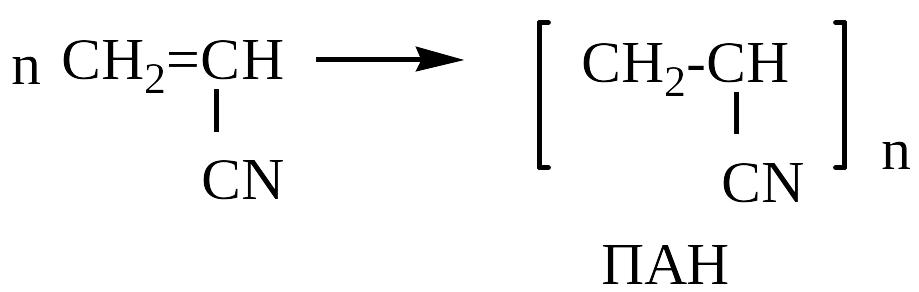
4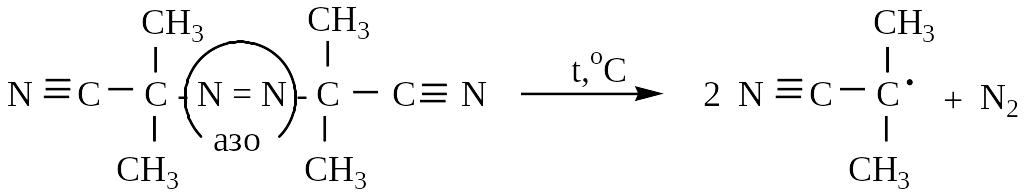 .
Инициатор радикальной полимеризации:
.
Инициатор радикальной полимеризации:
,’-азо-бис(изобутиронитрил)
азодинитрилдиизомасляной кислоты
5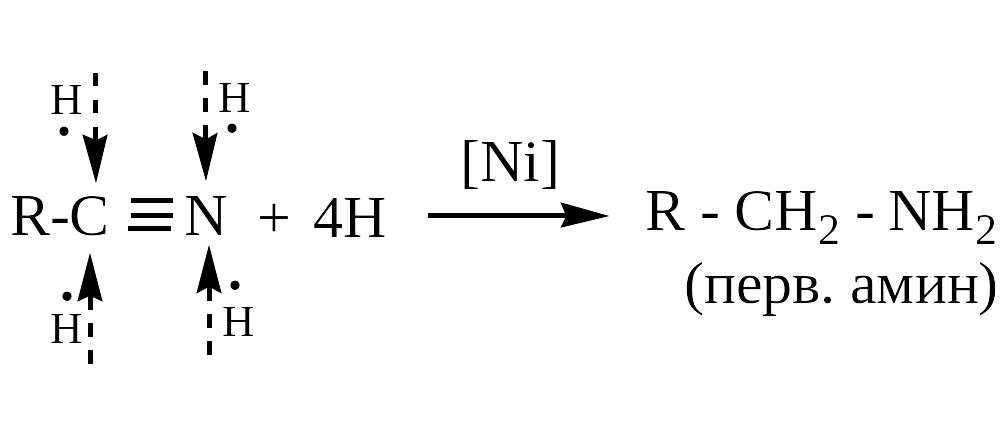 .
Восстановление
.
Восстановление
