
- •Работа 1. Изучение механизма электрохимической коррозии металлов на модели микроэлемента
- •1.Теоретическая часть
- •2. Методика проведения работы
- •3. Порядок работы
- •3.1. Экспериментальное построение коррозионной диаграммы "ток - потенциал"
- •3.2. Исследование влияния перемешивания раствора на скорость коррозии
- •3. Исследование влияния добавок кислоты в раствор
- •2. Методика и порядок проведения работы
- •3. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Работа №3. Влияние концентрации серной кислоты на скорость коррозии углеродистои стали
- •1. Теоретическая часть
- •2. Методика и порядок проведения работы
- •Контрольные вопросы
- •Литература
- •Работа №5. Катодная защита металлов от электрохимической коррозии.
- •1. Теоретические основы метода катодной защиты
- •2. Описание установки и порядок проведения.
- •2. Порядок проведения работы
- •Контрольные вопросы:
- •Литература:
- •Работа №7 исследование процесса коррозии металлов в кислотах
- •1. Теоретическая часть
- •2. Методика работы.
- •3. Порядок работы
- •Контрольные вопросы
- •Библиографический список
2. Описание установки и порядок проведения.
В работе исследуют катодную защиту стальных образцов в растворе серной кислоты. Пять стальных образцов зачищают наждачной бумагой, тщательно протирают и взвешивают на аналитических весах. Затем каждый из них погружают в отдельный стакан с кислотой. Образцы в первых трёх стаканах и вспомогательные электроды из свинца соединяют последовательно, как показано на рис.5.3 и подключают к внешнему источнику постоянного тока. К крайнему стальному образцу подключается отрицательный полюс источника тока, к крайнему свинцовому - положительный. Уровень кислоты в стаканах выбирается таким, чтобы площадь соприкосновения с кислотой (S, см2) у каждого последующего образца увеличивалась приблизительно в два раза по сравнению с предыдущим. Это необходимо для того, чтобы при пропускании одинакового по величине электрического тока (I, мА) плотность тока (i, мА/см2) на межфазной границе заметно изменялась.
i = I / S , (5.9)
Величина пропускаемого тока (50-80 мA) контролируется амперметром.
В четвертый стакан вспомогательный электрод не погружается, так как через стальной образец, находящийся в нем, ток не пропускается и он корродирует без катодной защиты.
Пятый образец соединяют проводником электрического тока с цинковым протектором и помещают их в пятый стакан с кислотой.
Длительность эксперимента составляет 10 минут. Во время опыта необходимо произвести замеры электродного потенциала каждого из стальных образцов. Для этого в каждый из пяти стаканов последовательно помещают медный электрод сравнения и относительно него вольтметром измеряют потенциал стального электрода. Для уменьшения омического падения напряжения в электролите и повышения точности измерения разности потенциалов стальной электрод необходимо размещать вблизи медного. После отключения тока стальные электроды вынимают из электролита, промывают водой и сушат. Затем их взвешивают и производят замер величины поверхности, контактирующей с кислотой.
Результаты измерений записывают в табл.5.1. На основании табличных данных рассчитывают скорость коррозии (V, моль/см2)
V = (mO – mK) / (MSτ) (5.10)
Здесь mO и mK, - начальная и конечная масса стального электрода, г; М - молярная масса железа, г/моль; S - площадь рабочей поверхности электрода, см2; τ - время опыта, с. По уравнениям (5.7) - (5.9) рассчитывают коэффициент торможения, степень защиты и плотность катодного тока. Оформляя отчет к данной лабораторной работе, строят графические зависимости электродного потенциала, коэффициента торможения и степени защиты от плотности тока.
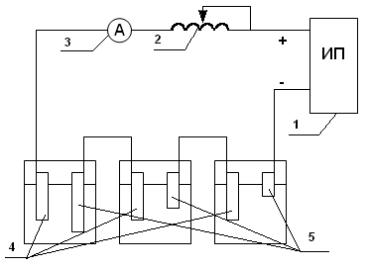
Рис.5.3. Схема установки для исследования катодной зашиты металлов — от коррозии: 1 - источник питания постоянного тока; 2-реостат; 3 - амперметр; 4 - вспомогательные свинцовые электроды; 5 - исследуемые стальные электроды
В выводах кратко резюмируют полученные результаты, обсуждают влияние плотности катодного тока на эффективность защиты, дают практические рекомендации о выборе оптимальных условий зашиты.
Таблица 5.1
Результаты испытаний
Результаты измерений |
Номер образца |
||||
1 |
2 |
3 |
4 |
5 |
|
Рабочая поверхность S, см2 |
|
|
|
|
|
Начальная масса mO, г |
|
|
|
|
|
Конечная масса mK, г |
|
|
|
|
|
Убыль (mO – mK), г |
|
|
|
|
|
Электродный потенциал, В |
|
|
|
|
|
Скорость коррозии V, моль/см2·с |
|
|
|
|
|
Коэффициент торможения γ |
|
|
|
|
|
Степень защиты Z |
|
|
|
|
|
Плотность тока, мА/см2 |
|
|
|
|
|
Контрольные вопросы
В чем заключается сущность метода катодной защиты?
Как выражается эффективность защиты?
Каков порядок проведения работы?
Что характеризует ток полной защиты?
В чем заключаются недостатки метода катодной защиты?
Литература:
Жук Н.П. Курс теории коррозии и защиты металлов. М.: Металлургия, 1976. 472 с.
Шлугер М.А., Ажогин Ф.Ф., Ефимов Е.А. Коррозия и защита металлов. М.: Металлургия, 1981. 216 с.
Работа №6. Электролитическое лужение стали.
1. Общие сведения об оловянных покрытиях и методах их получения
Цель работы - изучение метода электролитического нанесения олова на поверхность стали и свойств образующегося покрытая.
Ежегодно в мире выпускается свыше 10 миллионов тонн луженой жести, большая часть которой используется для изготовления консервных банок. Лужение можно производить электролитически или методом погружения в расплав олова.
Метод горячего лужения позволяет получать толстые, малопористые покрытия; но неравномерные по толщине. Кроме того, происходит большой угар олова и его потери, связанные с образованием интерметаллидов FeSn2. Электроосажденные оловянные покрытия равномернее полученых из расплава, толщину их можно легко регулировать , поэтому большую часть жести покрывают оловом электролитически.
Толщина слоя олова, нанесенного из расплава, составляет 0,0015- - 0,0038 мм (11 - 28 г/м2). Средняя толщина электролитических покрытий на консервных банках - 0,00045 мм (3,3 г/м2). Столь тонкие оловянные покрытия экономически выгодны, но более пористы, чем получаемые при горячем лужении. Для снижения пористости покрытия его часто оплавляют в печах.
Олово обладает значительной химической стойкостью: медленно окисляется в атмосфере влажного воздуха, длительное время не тускнеет даже при наличии в атмосфере сернистых соединений, весьма устойчиво в разбавленных растворах серной и соляной кислот, а также щелочей. Нетоксичность продуктов коррозии олова делает луженую жесть идеальной для изготовления тары для жидких и твердых пищевых продуктов. Однако для того, чтобы тонкое пористое оловянное покрытие хорошо выполняло свою защитную функцию, оно должно служить протектором по отношению к железу.
Стандартный потенциал олова равен -0,135 В, железа -0,440 В. В соответствии с этим в неорганических электролитах олово является катодным покрытием по отношению к железу и защищает его только механически. Этот случай реализуется, например, на внешней поверхности луженой тары. Однако на внутренней поверхности олово почти всегда анодно по отношению к железу, поэтому здесь возникают условия для протекторной защиты стальной основы. Столь благоприятная перемена полярности происходит в результате следующих причин.
В органических кислотах (щавелевая, лимонная, яблочная и т.п.), входящих в состав пищевых продуктов, катионы олова способны взаимодействовать с присутствующими в них комплексообразующими ионами (Х-)
Sn2+ + nX- = SnX(n-2)- (6.1)
Если равновесие реакции (6.1) сильно смещено в сторону образования комплексных соединений SnX(n-2)-, то равновесный потенциал олова
![]() (6.2)
(6.2)
сдвигается в отрицательном направлении, так как активность катионов олова в электролите уменьшается. При этом равновесный потенциал олова может стать отрицательнее равновесного потенциала железа. Таким образом, в органических электролитах при наличии несплошного покрытия олово в паре с железом становится анодом и защищает его электрохимически.
Электролитическое осаждение олова проводят в гальванической ванне постоянного тока. Покрываемый металлом образец стали подвешивают на катод. В качестве анодов используют пластины из осаждаемого металла (растворимые аноды).
Обязательный компонент электролита - ион металла, осаждающийся на катоде. Кроме того, в состав электролита могут входить вещества, повышающие его электропроводность, регулирующие протекание анодного процесса, обеспечивающие постоянство основности, а также поверхностно-активные добавки, повышающие поляризацию катодного процесса, блескообразующие и выравнивающие компоненты, обеспечивающие получение блестящих и гладких покрытий без последующей механической полировки.
Гальваническое осаждение металла происходит в результате электрохимической реакции разряда гидратированных ионов олова на катоде до атомов и достраивания ими кристаллической решетки покрытия
Sn2+ + 2е = Sn (6.3)
Одновременно с разрядом ионов металла может протекать электродная реакция выделения водорода
2Н+ + 2е = Н2 (6.4)
На аноде протекают процессы электрохимического растворения оловянного электрода
Sn = Sn2+ + 2e (6.5)
и выделения кислорода
4ОН– = 02 + 2Н20 + 4е (6.6)
Электроосаждение олова протекает по стадиям, важнейшими из которых являются следующие:
доставка разряжающихся ионов металла из объема электролита к поверхности катода путем конвекции и диффузии;
разряд гидратированных ионов металла, включающий частичную или полную дегидратацию ионов и адсорбцию разряжающихся частиц на электроде;
диффузия атомов олова по поверхности электрода к местам кристаллизации;
образование и рост кристаллических зародышей.
Согласно современным представлениям электрокристаллизация происходит одновременно не на всей поверхности электрода, а сначала лишь на активных участках, получивших название мест роста. К ним относятся вершины углов и ребер кристалла, дефекты поверхности катода.
Сначала возникают кристаллические зародыши, которые затем растут вследствие присоединения разрядившихся атомов металла. Структура покрытия определяется соотношением скоростей образования кристаллических зародышей и их роста. Чем выше относительная скорость образования зародышей, тем более мелкозерниста структура покрытия. Возникновение кристаллических зародышей сопряжено с большей затратой энергии по сравнению с их ростом. Поэтому повышение катодного перенапряжения, то есть замедление стадии разряда (6.3), способствует образованию мелкозернистых покрытий, которые обладают лучшими защитными свойствами.
Возможен, но нежелателен, процесс кристаллизации и без образования кристаллических зародышей равномерно на всей поверхности. Он происходит при малых катодных перенапряжениях на участках поверхности электрода, имеющих дефектные участки.
Скорость электроосаждения металла и величина перенапряжения определяются наиболее медленной стадией процесса. В зависимости от природы и состава раствора, качества обработки поверхности стального образца, режима электролиза, ею может быть любая из рассмотренных выше стадий.
В зависимости от того, в каком виде ион разряжающегося металла находится в растворе, электролиты делятся на комплексные и простые. Разряд комплексных ионов на катоде происходит при более высоком перенапряжении, чем разряд простых ионов. Поэтому покрытия, полученные из комплексных электролитов, более мелкозернисты и равномерны по толщине. Однако в этих электролитах ниже выход металла по току и меньше производительность.
Повышение плотности тока увеличивает катодное перенапряжение, скорость осаждения металла и производительность электролизера. Однако верхний предел ее ограничен эффектом дендритообразования, наступающим при достижении критической плотности тока, при которой скорость разряда ионов начинает превышать скорость поверхностной диффузии атомов.
Количество осаждаемого металла пропорционально количеству пропущенного через электрод электричества. Поэтому толщину покрытия (h, см) можно рассчитать, используя закон Фарадея:
![]() (6.7)
(6.7)
где I - сила тока. А; τ - продолжительность электролиза, с; М- молярная масса олова, г/моль; В - выход по току, %; F - постоянная Фарадея, Кл/моль; ρ - плотность олова, г/см ; S - площадь поверхности оловянного покрытия, см2.
