
- •Работа 1. Изучение механизма электрохимической коррозии металлов на модели микроэлемента
- •1.Теоретическая часть
- •2. Методика проведения работы
- •3. Порядок работы
- •3.1. Экспериментальное построение коррозионной диаграммы "ток - потенциал"
- •3.2. Исследование влияния перемешивания раствора на скорость коррозии
- •3. Исследование влияния добавок кислоты в раствор
- •2. Методика и порядок проведения работы
- •3. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Работа №3. Влияние концентрации серной кислоты на скорость коррозии углеродистои стали
- •1. Теоретическая часть
- •2. Методика и порядок проведения работы
- •Контрольные вопросы
- •Литература
- •Работа №5. Катодная защита металлов от электрохимической коррозии.
- •1. Теоретические основы метода катодной защиты
- •2. Описание установки и порядок проведения.
- •2. Порядок проведения работы
- •Контрольные вопросы:
- •Литература:
- •Работа №7 исследование процесса коррозии металлов в кислотах
- •1. Теоретическая часть
- •2. Методика работы.
- •3. Порядок работы
- •Контрольные вопросы
- •Библиографический список
2. Методика и порядок проведения работы
Прибор для определения скорости коррозии по количеству выделившегося водорода показан на рис.2.3. Он состоит из газовой бюретки 2, расширенной в нижней части, и стакана 1 с раствором кислоты 4. Металлический образец 5 следует поместить так, чтобы все всплывающие пузыри водорода попадали в бюретку. В используемом в работе методе количество выделившегося водорода определяют по количеству кислоты, вытесненной им из бюретки.
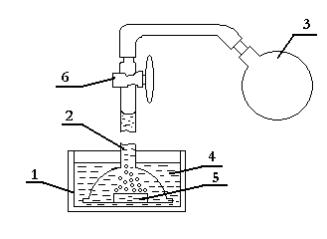
Рис.2.3. Схема водородного коррозиметра: 1 - стакан; 2 - газовая бюретка; 3 - резиновая груша; 4 - раствор кислоты; 5 - металлический образец; 6 – кран.
В данной работе следует измерить скорости коррозии низкоуглеродистой и высокоуглеродистой стали в 40% растворе серной кислоты и цинка в 10% растворе серной кислоты. Перед началом опыта поверхность образцов зачищают наждачной бумагой и с помощью масштабной линейки определяют размеры образцов. После этого первый образец помещают в раствор и над ним устанавливают расширенную часть бюретки. Затем с помощью резиновой груши бюретка заполняется раствором, и краник 6 закрывается.
Когда установка готова к опыту, по секундомеру отмечается время прохождения уровнем кислоты делений, отмеченных на бюретке. Производится 8-10 замеров. Аналогично проводят опыты со вторым и третьим образцами. После окончания опытов образцы следует промыть и насухо вытереть. Затем следует пересчитать полученные данные так, чтобы первому замеру соответствовали объём водорода и момент времени, равные нулю. Результаты расчётов заносят в табл.2.1.
Таблица 2.1
Результаты измерения
№ п/п |
Объем выделившегося водорода, см3 |
Время от начала опыта, сек |
||
Цинк |
Низкоуглеродистая сталь |
Высокоуглеродистая сталь |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Обработка результатов измерений
1.
Полученные данные наносят на график -
объем выделившегося водорода- время
("V - τ").
На данном графике отмечают участок
установившейся скорости выделения
водорода (начальный участок может быть
более пологим, т.к. выделяющийся водород
сначала задерживается на поверхности
металлического образца и на стенках
расширенной части бюретки; кроме того,
площадь катодных участков может со
временем несколько увеличиться). По
наклону этого участка определяют
количество выделяющегося водорода за
определённый промежуток времени
![]() . Переводя данный объём водорода в
эквивалентную массу металла
. Переводя данный объём водорода в
эквивалентную массу металла
![]() , рассчитывают среднюю скорость коррозии
, рассчитывают среднюю скорость коррозии
![]() по формуле
по формуле
 ;
;
где
![]() -
площадь
поверхности образца.
-
площадь
поверхности образца.
Величину находят по количеству выделившегося водорода исходя из того, что при растворении одного моля двухвалентного металла выделяется при нормальных условиях 22,4 литра водорода. Допускается принять, что при коррозии сталей растворяется только железо.
Рассчитывают глубинный показатель коррозии, который характеризует среднюю глубину ее проникновения и выражается в мм/год. Его можно вычислить по формуле:
![]() мм/год,
мм/год,
где
-
средняя скорость коррозии, г/м2·час;
![]() - плотность металла, г/см3
(
Fe
= 7,8 г/см3;
Zn
= 7,1 г/см3).
В выводах следует в краткой форме
изложить основные качественные и
количественные результаты и объяснить
причины разной коррозионной стойкости
металлов.
- плотность металла, г/см3
(
Fe
= 7,8 г/см3;
Zn
= 7,1 г/см3).
В выводах следует в краткой форме
изложить основные качественные и
количественные результаты и объяснить
причины разной коррозионной стойкости
металлов.
