
- •Работа 1. Изучение механизма электрохимической коррозии металлов на модели микроэлемента
- •1.Теоретическая часть
- •2. Методика проведения работы
- •3. Порядок работы
- •3.1. Экспериментальное построение коррозионной диаграммы "ток - потенциал"
- •3.2. Исследование влияния перемешивания раствора на скорость коррозии
- •3. Исследование влияния добавок кислоты в раствор
- •2. Методика и порядок проведения работы
- •3. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Работа №3. Влияние концентрации серной кислоты на скорость коррозии углеродистои стали
- •1. Теоретическая часть
- •2. Методика и порядок проведения работы
- •Контрольные вопросы
- •Литература
- •Работа №5. Катодная защита металлов от электрохимической коррозии.
- •1. Теоретические основы метода катодной защиты
- •2. Описание установки и порядок проведения.
- •2. Порядок проведения работы
- •Контрольные вопросы:
- •Литература:
- •Работа №7 исследование процесса коррозии металлов в кислотах
- •1. Теоретическая часть
- •2. Методика работы.
- •3. Порядок работы
- •Контрольные вопросы
- •Библиографический список
3. Исследование влияния добавок кислоты в раствор
Измеряют и записывают в табл.1.2 величину тока короткозамкнутой пары до и после добавления в анодное пространство 1 - 2 капель концентрированной серной кислоты. Через 2 минуты добавляют такое же количество H2SO4 в катодное пространство и снова фиксируют I.
Таблица 1.2
Влияние перемешивания и добавок H2SO4 на величину тока короткозамкнутого гальванического элемента
Изучаемый фактор |
Ток при операциях в анодном пространстве, мА |
Ток при операциях в катодном пространстве, мА |
|
Перемешивание |
До перемешивания |
|
|
При перемешивании |
|
|
|
После перемеши- вания |
|
|
|
Добавка H2SO4 |
До добавления |
|
|
После добавления |
|
|
|
После опытов магазин сопротивлений устанавливают в положение R =, вынимают электроды, промывают их водой и сушат фильтровальной бумагой. Раствор выливают, сосуд промывают водой.
По данным табл.1.1 строят коррозионную диаграмму «ток - потенциал». По формулам 1.6, 1.7, 1.8 рассчитывают степени анодного, катодного и омического контроля в неперемешиваемом электролите при R =0.
В выводах следует обсудить величины долей контроля СА, СК и СОм и указать вид контроля (анодный, катодный или омический). Описать влияние изучаемых факторов на ток коррозии, сделать заключение об основном лимитирующем этапе коррозии.
Контрольные вопросы
Какие основные процессы протекают на границе металл - электролит при коррозии металлов в водных средах?
На какие этапы можно разбить анодный и катодный процессы?
Что такое лимитирующий этап?
Как можно выявить этап, лимитирующий процесс коррозия?
Что такое стационарный потенциал металла?
Что означают понятия анодного, катодного и омического контроля?
Литература:
Жук Н.П. Курс теории коррозии и защиты металлов. М.: Металлургия 1976.
Скорчелетти В.В. Теоретические основы коррозии металлов. Л.: Химия, 1973.
Улит Г.Г. Коррозия и борьба с ней. Л.: Химия, 1989.
Работа №2. Определение скорости коррозии металлов в кислотах по количеству выделившегося водорода.
Цель работы - исследование влияния природы металла на скорость его коррозии в кислых средах.
1. Теоретическая часть
Коррозия большинства металлов в кислых электролитах протекает по электрохимическому механизму. На поверхности твердого металла формируются участки, на которых протекает либо анодный (см. рис.2.1)
![]() Me+mH2O=Mez+·mH2O+ze
(2.1)
Me+mH2O=Mez+·mH2O+ze
(2.1)
либо катодный процесс, которым в кислых средах является, как правило, водородная деполяризация
2H3O+ + 2e = H2 + 2H2O (2.2)
Электролит

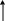 H3O+
H3O+


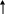 Мея+·mH2O
H2
Мея+·mH2O
H2
 Me
e
Me
e
Анод Катод
Рис.2.1. Схема электрохимической коррозии металла с водородной деполяризацией
Обмен электронами между катодными и анодными участками происходит легко и не вызывает затруднений. В стационарных условиях скорости анодного и катодного процессов равны и процесс коррозии лимитируется одним из этапов анодного или катодного процессов, либо переносом тока через электролит. Равенство скоростей анодного и катодного процессов означает, что количество растворившегося на аноде, то есть прокорродировавшего металла, согласно электродной полуреакции (2.1) эквивалентно количеству выделившегося на катоде по полуреакции (2.2) водорода, что положено в основу используемого в данной работе метода.
Влияние основных факторов на скорость коррозии металлов в кислотах удобно рассмотреть с помощью коррозионной диаграммы "ток - потенциал", представленной на рис.2.2.
Р ис.2.2.
Коррозионная диаграмма для процесса
растворения металлов в кислоте:
ис.2.2.
Коррозионная диаграмма для процесса
растворения металлов в кислоте:
поляризационная кривая для анодного процесса на металлах №1 и №2
поляризационная кривая для анодного процесса на металле №3
поляризационная кривая для катодного процесса на металле №1
поляризационная кривая для катодного процесса на металлах №2 и №3
![]() 1,2
,
3
,
1,2
,
3
,
![]() - равновесные
потенциалы металлов №1, №2, №3 и водорода
в данном электролите;
- равновесные
потенциалы металлов №1, №2, №3 и водорода
в данном электролите;
![]() 1,
2,
3
-
стационарные потенциалы металлов №1,
№2, №3; I1,
I2,
I3
- коррозионные токи для металлов №1, №2
и №3.
1,
2,
3
-
стационарные потенциалы металлов №1,
№2, №3; I1,
I2,
I3
- коррозионные токи для металлов №1, №2
и №3.
Рассмотрим коррозию металла №1, например, низкоуглеродистой стали, в электролите с высокой электропроводностью (т.е. когда омическим падением напряжения в электролите можно пренебреч). Поляризационные кривые на катодных и анодных участках металла №1 представлены на рис.2.2 линиями 1 и 3. Поскольку в стационарных условиях в системе не происходит накопления заряда, общий ток, протекающий через все анодные участии IА равен общему току, протекающему через все катодные участки IК:
IA=IК или iA*SA=IK*SK (2.3)
где iA и iK - плотности анодного и катодного тока; SA и SK - суммарные площади поверхности всех анодных и катодных участков.
Следовательно, условия коррозии металла №1 на диаграмме (2.2) будут определяться точкой пересечения линий 1 и 3. При этом установится стационарный электродный потенциал 1 и коррозионный ток I1, характеризующий скорость коррозии. Из условия (2.3) следует также, что крутизна поляризационных кривых I=f() зависит не только от кинетических характеристик этапов анодного и катодного процессов, определяющих плотности тока iA и iK, но и от площадей SA и SK.
Заменим низкоуглеродистую сталь (металл №1) высокоуглеродистой - металл №2, а состав электролита оставим прежним. Увеличение содержания углерода в стали увеличит общее количество обогащенных углеродом участков поверхности - зерен цементита. Эти участки имеют более положительный электродный потенциал, чем низкоуглеродистые (феррит), т.е. являются катодами. Следовательно, при такой замене возрастет общая площадь катодных участков SК, а значит, катодная поляризационная кривая пойдет круче - линия 4. Для углеродистой стали характерно соотношение SК<<SА, поэтому увеличение Sk при переходе от низкоуглеродистой к высокоуглеродистой стали мало изменит SA. Благодаря этому можно считать, что ход анодной поляризационной кривой (линия 1) не изменится при замене низкоуглеродистой стали на высокоуглеродистую. На металле установится стационарный потенциал 2, более положительный, чем 1 и ток коррозии (а значит, и ее скорость) возрастет до I2.
Не меняя электролита, возьмем металл №3, имеющий значительно более отрицательный равновесный потенциал 3 , например, цинк. Для упрощения будем считать, что общая площадь поверхности катодов и ток обмена разряда водорода на цинке такие же, как и на высокоуглеродистой стали. Значит, кривая 4 будет пригодна для описания катодного процесса и на цинке, так как сама электродная полуреакция (2.2) и концентрации входящих в нее компонентов остались неизменными. Точка пересечения анодной поляризационной кривой 2 и катодной кривой 4 даст стационарный потенциал металла 3 и резко возросший ток коррозии I3.
Кроме обсужденных выше причин разной устойчивости различных металлов в растворах кислот:
различная суммарная площадь катодных участков на поверхности металла у металлов разного состава;
различная величина равновесного электродного потенциала металлов (чем отрицательнее , тем больше ток коррозии, так как не изменяется при замене металла (см. рис.2.2)),
на скорость коррозии влияют:
различная поляризуемость металлов (для более поляризуемых линия 1 на рис.2.2 располагается ближе к оси потенциалов);
различная скорость разряда водорода на различных металлах (с уменьшением тока обмена полуреакции (2.2) скорость коррозии может уменьшиться);
изменение условий подвода и отвода реагентов катодного процесса (2.2);
пассивация металлов, т.е. появление на их поверхности защитных оксидных пленок, резко снижающих скорость коррозии.
