
- •Работа 1. Изучение механизма электрохимической коррозии металлов на модели микроэлемента
- •1.Теоретическая часть
- •2. Методика проведения работы
- •3. Порядок работы
- •3.1. Экспериментальное построение коррозионной диаграммы "ток - потенциал"
- •3.2. Исследование влияния перемешивания раствора на скорость коррозии
- •3. Исследование влияния добавок кислоты в раствор
- •2. Методика и порядок проведения работы
- •3. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Работа №3. Влияние концентрации серной кислоты на скорость коррозии углеродистои стали
- •1. Теоретическая часть
- •2. Методика и порядок проведения работы
- •Контрольные вопросы
- •Литература
- •Работа №5. Катодная защита металлов от электрохимической коррозии.
- •1. Теоретические основы метода катодной защиты
- •2. Описание установки и порядок проведения.
- •2. Порядок проведения работы
- •Контрольные вопросы:
- •Литература:
- •Работа №7 исследование процесса коррозии металлов в кислотах
- •1. Теоретическая часть
- •2. Методика работы.
- •3. Порядок работы
- •Контрольные вопросы
- •Библиографический список
Работа 1. Изучение механизма электрохимической коррозии металлов на модели микроэлемента
Цель работы - исследование процессов поляризации и деполяризации электродов на модели коррозионного микроэлемента.
1.Теоретическая часть
Коррозия металлов в жидких средах в подавляющем большинстве случаев протекает по электрохимическому механизму. На поверхности металла возникают гальванические микроэлементы, совокупная деятельность которых приводит к его коррозионному разрушению. Причиной возникновения гальванических микроэлементов является различие химических и физических свойств отдельных участков металлической поверхности или прилегающих к ним слоев электролита. Участки поверхности металла, имеющие на границе с электролитом более положительный электродный потенциал становятся катодами, а более отрицательный - анодами.
При коррозии в водных средах на анодах будет происходить растворение металла с образованием гидратированных ионов и нескомпенсированных электронов:
Me+mH2O=Mez+·mH2O+ze (1.1)
На катодах, в зависимости от конкретных условий, наиболее вероятны два процесса:
а) при контакте нейтрального или основного электролита с атмосферой преобладает кислородная деполяризация:
O2 + 2H2O + 4e = 4OH- (1.2)
б) если электролит кислый, то преобладать будет водородная деполяризация:
2H3O+ + 2e = H2 + 2H2O (1.3)
Схема коррозионного гальванического элемента представлена на рис. 1.1.а. Электрохимическая коррозия на неоднородной поверхности металла аналогична работе короткозамкнутого гальванического элемента. Поэтому процесс коррозии, состоящий из анодного процесса, перетекания электронов по металлу, прохождения электрического тока через электролит и катодного процесса, может быть смоделирован на обычном гальваническом элементе, изображенном на рис. 1.1.б.






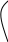
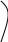
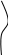



 Am-
Кn+
А
К D
+ qe = Dq-
Am-
Кn+
А
К D
+ qe = Dq-





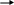 Me – ze = Mez+
Ме Мея+
Dq-
Me – ze = Mez+
Ме Мея+
Dq-
АНОД КАТОД D

Рис.1.1. Схемы гальванических элементов: А - анод; К - катод; е - электрон; Ме - атом металла; D - частица деполяризатора (Н30+ или 02); z - заряд иона металла; q - заряд иона деполяризатора
Анодный и катодный процессы, в свою очередь, могут быть разбиты на этапы. Так, анодный процесс состоит из:
электродной полуреакции растворения металла (1.1);
отвода гидратированных ионов металла в объем электролита, либо достройки пленки твердого продукта коррозии на поверхности металла.
Этапы катодного процесса:
растворение газообразного деполяризатора в электролите;
конвективная диффузия растворенного деполяризатора к поверхности металла;
собственно электрохимический процесс (1.2) или (1.3);
отвод растворимых продуктов в объем электролита за счет конвективной диффузии либо удаление газообразных продуктов.
Анодный процесс (1.1) обычно лимитируется диффузией ионов металла в растворе, катодный процесс (1.2) - диффузией растворенного в электролите кислорода, а процесс (1.3) чаще всего - разрядом ионов водорода.
Когда коррозия протекает в стационарных условиях (все параметры системы не изменяются со временем), ток анодного процесса, ток катодного процесса, а также ток, протекающий через металл и электролит, равны между собой. Это означает, что скорость растворения металла (анодный процесс) может лимитироваться не только этапами анодного процесса, но и этапами катодного процесса или протеканием электрического тока через электролит, если эти стадии происходят с бóльшим сопротивлением, чем анодный процесс.
При протекании тока электродные потенциалы катодных к и анодных ме участков металла не будут равны равновесным потенциалам Рк и Рме. Смещение электродного потенциала от его равновесного значения называют электродным перенапряжением η
η = - Р (1.4)
а зависимость η=f(i), где i – плотность тока, протекающего через границу «металл – электролит» – поляризационной кривой. Причинами поляризации являются замедленность собственно электрохимических актов процессов (1.1) - (1.3), либо замедленность диффузии реагентов в растворе.
Влияние различных факторов на скорость коррозии металла (прямо пропорциональной суммарному току, протекающему через анодные участки) удобно анализировать с помощью коррозионной диаграммы "ток - потенциал" (pис 1.2). Диаграмма представляет собой нанесенные в одной системе координат зависимости электродного потенциала от общего тока для анодного и катодного процессов, протекающих на корродирующем образце.
Коррозионные гальванические элементы являются короткозамкнутными, поэтому в случае высокой электропроводности электролита в стационарных условиях на анодах и катодах установится общий стационарный электродный потенциал С. Поскольку в стационарных условиях общий ток, протекающий через анодные участки (IА), будет равен общему току, протекающему через катодные участки (Iк):
iA · SA = iK · SK или IA=IK (1.5).
где iA и iK - средние плотности анодного и катодного токов; SA и SK - площади поверхностей всех анодных и всех катодных участков, точка А пересечения кривых 1 и 2 определяет значения коррозионного тока I и стационарного потенциала C .

Рис.1.2. Коррозионная диаграмма "ток - потенциал": 1 - анодная поляризационная кривая; 2- катодная поляризационная кривая, полученная в условиях без принудительной конвекции; 3 - катодная поляризационная кривая, полученная в условиях с принудительной конвекцией; Iм и I - токи коррозии; РА и РK - равновесные электродные потенциалы анода и катода; C и ’’C - стационарные электродные потенциалы; А и К - потенциалы анода и катода при заметном омическом контроле; ηА и ηК - электродные перенапряжения на аноде и на катоде; ΔUом - омическое падение напряжения в электролите.
Если электропроводность электролита невелика и сопротивлением протекания тока через электролит пренебречь нельзя, то потенциал анода А будет отличаться от потенциала катода К на величину омического падения напряжения в электролите ΔUом. Соответственно уменьшится ток коррозии с I до I’, а значит, и скорость растворения металла.
Еще одним фактором, влияющим на скорость коррозии, является скорость конвективных потоков в электролите. Управление скоростью конвекции, например, с помощью мешалки, способствует выявлению лимитирующего этапа коррозионного процесса. Рассмотрим случай, когда катодный процесс лимитируется диффузией компонентов в растворе, а анодный - замедленным разрядом атомов металла по реакции (1.1). Принудительное перемешивание раствора скажется на катодном процессе, снизив его сопротивление, и практически не повлияет на сопротивление анодного процесса. В новых условиях катодная поляризационная кривая пойдет выше - линия 3, следовательно, ток коррозии возрастет до I’’, а стационарный потенциал сместится в положительную сторону до значения ’’C.
При использовании принудительной конвекции для выявления этапа, тормозящего весь процесс коррозии, следует помнить, что все этапы анодного и катодного процессов, а также прохождение тока через электролит протекают последовательно, и любой из них, включая и прохождение тока может лимитировать весь процесс коррозии.
Например,
если перемешивание электролита в анодном
пространстве (при неизменной скорости
потоков вблизи катода) не ускорило
коррозию, то это еще не значит, что самым
медленным из всех этапов является
разряд ионов металла (1.1). В этом случае
процесс коррозии может лимитировать
также один из этапов катодного процесса
и прохождение тока через электролит.
Однако же, если перемешивание электролита
в прикатодной области увеличит скорость
коррозия (или ток гальванического
элемента) прямо пропорционально величине
![]() , где Un1
и Un2
- скорости конвективных потоков
электролита до начала перемешивания
и при перемешивании, то это однозначно
свидетельствует о том, что диффузионный
этап катодного процесса лимитирует
коррозию в данном случае. Последнее
утверждение основывается на том, что
скорость всего коррозионного процесса
увеличилась ровно во столько же раз, во
сколько раз возросла скорость диффузионного
этапа катодного процесса.
, где Un1
и Un2
- скорости конвективных потоков
электролита до начала перемешивания
и при перемешивании, то это однозначно
свидетельствует о том, что диффузионный
этап катодного процесса лимитирует
коррозию в данном случае. Последнее
утверждение основывается на том, что
скорость всего коррозионного процесса
увеличилась ровно во столько же раз, во
сколько раз возросла скорость диффузионного
этапа катодного процесса.
Долю контроля общего процесса каждой его ступенью характеризуют отношениями:
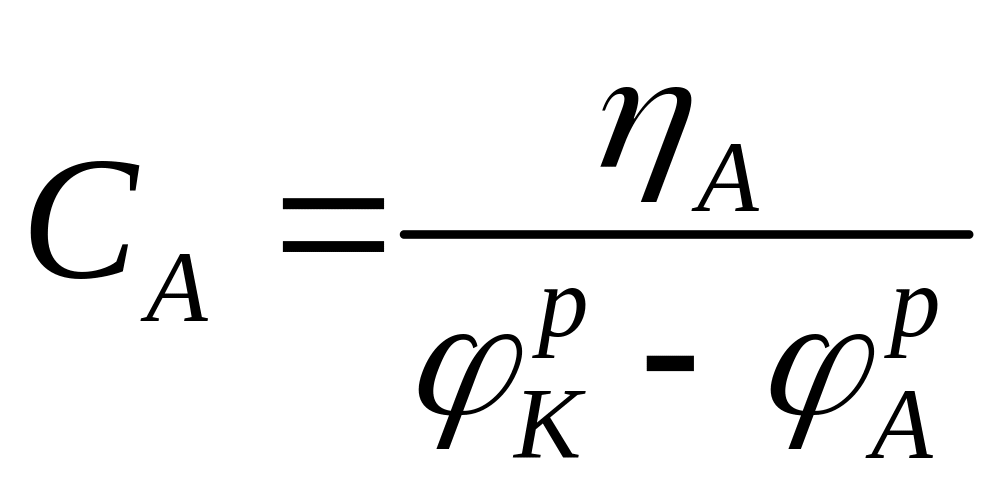 - долей анодного контроля ,
(1.6)
- долей анодного контроля ,
(1.6)
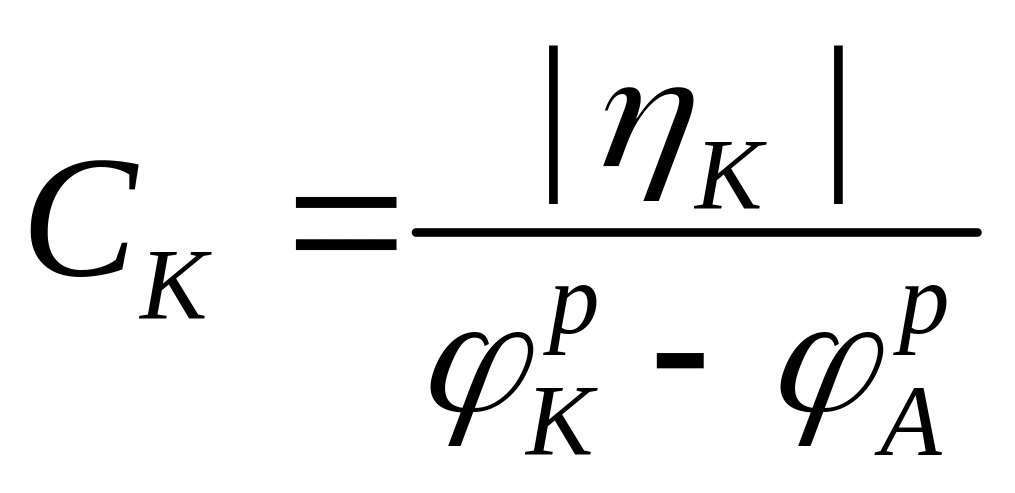 - долей катодного
контроля , (1.7)
- долей катодного
контроля , (1.7)
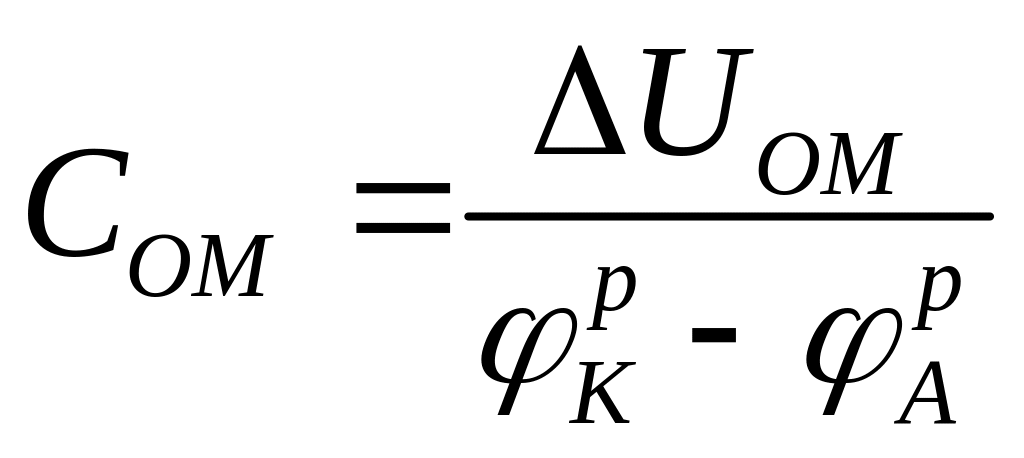 - долей омического
контроля. (1.8)
- долей омического
контроля. (1.8)
Из рис. 1.2 следует, что ηA+|ηK|+ΔUОм=РК - РА. Поэтому CA+CK+CОм=1.
