
- •2. Воспламенение
- •2.1. Адиабатические химические превращения
- •2.2. Два типа воспламенения
- •2.3. Стационарная теория теплового воспламенения
- •2.4. Нестационарная теория теплового взрыва
- •2.5. Тепловой взрыв в динамических условиях /4/
- •2.6. Вынужденное воспламенение (зажигание)
- •2.7. Тепловая теория зажигания
- •Процесс горения
- •Диффузионное и кинетическое горение
- •Диффузионное пламя
- •Расход воздуха на горение
- •После преобразования получим
- •Продукты сгорания. Дым
- •Определяем объем влажных продуктов сгорания метана
- •Теплота сгорания
- •Температура горения
- •Оценка пожарной опасности веществ и материалов
- •Превращение горючих веществ при нагревании
- •Теория окисления горючих веществ
- •Цепь Разветвление
- •Теория самовоспламенения
- •Температура самовоспламенения
- •Процесс возгорания и воспламенения
2.4. Нестационарная теория теплового взрыва
Эта теория была разработана Н.Н. Семеновым в 1940 г.
Рассмотрим простую систему. Пусть некоторый объем газа заключен в сосуд, стенки которого неизменно поддерживаются при заданной температуре То. Предположим, что при реакции температура внутри сосуда везде одинакова и равна Т. Ввиду этого вся разница температур между газом и стенкой сосредоточена на границе между ними. Соответственно этому внутри сосуда в газе не существует различия в концентрациях реагирующих веществ.
Напишем два выражения - для скорости выделения тепла во всем объеме V и для отдачи тепла через стенки сосуда. Если тепловой эффект реакции равен Q Дж/моль, то скорость выделения тепла в сосуде„ содержащей V объемов газа, равна
![]() (2.28)
(2.28)
Это тепло идет частично на нагревание газа, частично теряется через стенки сосуда. Количество потерянного тепла запишем в виде
q2 =F(T-To),
где F - общая поверхность стенок сосуда.
Предположение, что внутри сосуда температура однородна, означает, что скорость выравнивания температур там очень велика, так что основное термическое сопротивление оказывает тонкий слой газа, прилегающий к стенкам сосуда; понятно, что в этом случае величина зависит как от формы и размеров сосуда, так и от температуры. Построим графики зависимости тепловыделения и теплоотвода от температуры (рис.2.3). Предположим, что до момента. воспламенения в сосуде не происходит изменения реагирующих веществ, т.о. концентрация постоянна и равна начальной Со. Система кривых 1,2,3 соответствует скорости выделения тепла для трех различных скоростей реакции (уравнение 2.21). Прямая 4 соответствует скорости отдачи тепла в зависимости от температуры внутри сосуда (2.29).
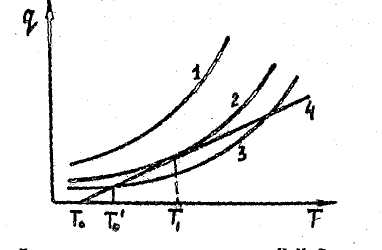
Рис.2.3. Диаграмма теплового взрыва Н.Н. Семенова: 1,2,3-тепловыделение;
4-теплоотвод
Когда реакция идет по кривой 3, то смесь будет разогреваться от Т0 до Т1, так как до этого момента теплоприход превышает теплоотвод. В точке Т1 нагрев прекратится. И система придет в равновесие. Реакция пойдет дальше с постоянной скоростью. Если количество реагирующих молекул не будет меняться, практически скорость будет падать.
В
случае, когда реакция описывается кривой
![]() тепловыделение
всегда превышает теплоотвод, и система
с самого начала непрерывно наращивает
температуру. Скорость реакции быстро
возрастает, что ведет к явлению взрыва.
тепловыделение
всегда превышает теплоотвод, и система
с самого начала непрерывно наращивает
температуру. Скорость реакции быстро
возрастает, что ведет к явлению взрыва.
Существует, очевидно, определенное условие, характеризующее переход от ограниченного роста температуры к неограниченному. Это условие реализуется для кривой 2. В этом случае произойдет возрастание температуры газа до величины Т1.
Начиная с этого момента система находится в равновесии. Но если равновесие в точке Т1 для кривой 3 было устойчивым (повышение То только несколько изменяло Т1) то равновесие Т4 явно неустойчиво. Небольшие флуктуации температуры приводят к превышению теплоприхода над теплоотводом и к прогрессивному саморазогреву системы.
Условием перехода системы к воспламенению является условие касания кривой теплоотвода к кривой тепловыделения. В этой точке имеет место равенство скоростей тепловыделения и теплоотвода.
q1=q2 2.30),
и равенство скоростей изменения этих количеств с температурой
![]() (2.31)
(2.31)
Эти два условия однозначно определяют величину T1, характеризующую для данной системы предельное условие воспламенения, и температура T1 носит название температуры воспламенения или самовоспламенения горючей смеси. Найдем критические условия теплового взрыва, т.е. значения параметров системы на границе между двумя возможными режимами протекания процесса - стационарной медленной реакцией н взрывом.
Кинетика процесса описывается уравнением
![]() .
.
Представим
его в безразмерном виде. Для этого, кроме
безразмерного
времени
![]() и
температуры Q
введем
параметр
æ
-- -критерий
Н.Н. Семенова
и
температуры Q
введем
параметр
æ
-- -критерий
Н.Н. Семенова
æ
=
![]() ,
,
где
![]() - характерное
время теплоотвода;
- характерное
время теплоотвода;
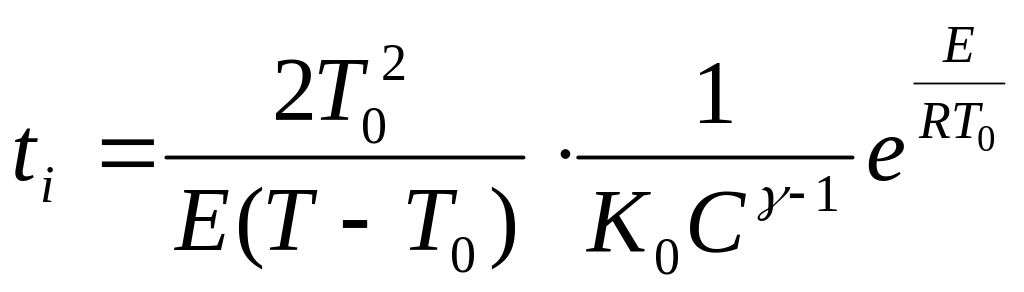 период
индукции адиабатической
реакции
период
индукции адиабатической
реакции
В этом случае уравнение (2.30) можно представить в следующем виде
![]() /æ
(2.30).
/æ
(2.30).
с
печальными условиями
![]() ,
Q=0.
,
Q=0.
Решения уравнения (2.31) имеет вид (О.М.Тодес) /3/
![]() ,
æ
=
,
æ
=![]() =const, (2.32)
=const, (2.32)
т.е. зависит oт одного безразмерного параметра, критическое значение которого необходимо определить. При достаточно больших æ характерной время теплоотдачи намного больше характерного времени тепловыделения, и тепло не успевает отводиться в стенки сосуда, должен произойти взрыв. В уравнении (2.31) это проявляется в том, что при достаточно больших æ. правая часть уравнения положительна при любых Q, т.е. уравнение
![]() (2.33)
(2.33)
не
имеет корней
![]() при
всех
- температура
смеси нeограниченно
увеличивается. Если
æ
имеет
такое значение, что
корни уравнения (2.33) вещественны, то
возможен стационарный
режим - температура сначала возрастает,
но только до такого
значения, при котором
обращается
в нуль, а далее реакция
идет при постоянной температуре.
при
всех
- температура
смеси нeограниченно
увеличивается. Если
æ
имеет
такое значение, что
корни уравнения (2.33) вещественны, то
возможен стационарный
режим - температура сначала возрастает,
но только до такого
значения, при котором
обращается
в нуль, а далее реакция
идет при постоянной температуре.
Условие теплового взрыва (рис.2.3) можно записать как условие касания функции expQ и Q/æ при некоторой температуре Q = Q*, а именно:
![]() ;
;
 (2.34)
(2.34)
и в этом случае условия воспламенения принимают: вид
Q*=1; æ*=1/l (2.35).
Решение (2.35) можно записать так:
T*
- T0
=![]() ;
;
![]() (2.36).
(2.36).
Существенным в теории Н.Н. Семенова является то, что к анализу нестационарного процесса применен стационарный подход, а именно: условия взрыва формулируется как условие исчезновения стационарного режиме (невозможность протекания медленной реакции с тепловыделением, уравновешенным теплообменом). Численные расчеты с высокой точностью подтверждают исходные предпосылки и выводы теории Н.Н. Семенова:
-
предвзрывной разогрев равен (в пределах
порядка) характеристическому
интервалу
![]() ;
;
-
выгорание смеси за период индукции
мало, и им можно пренебречь:
![]() <<1.
<<1.
Из приведенных расчетов можно сделать еще один важный вывод. Прологарифмировав выражение (2.36), получаем:
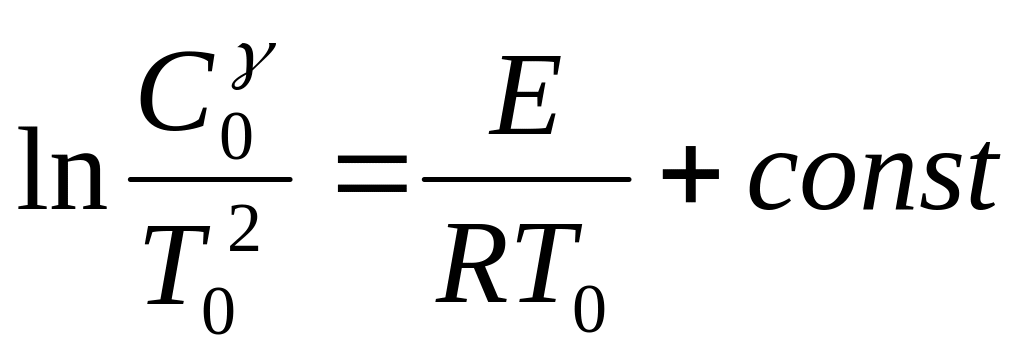 . (2.37)
. (2.37)
В
частности, для бимолекулярной реакции
в газовой фазе
![]() и
тогда
и
тогда
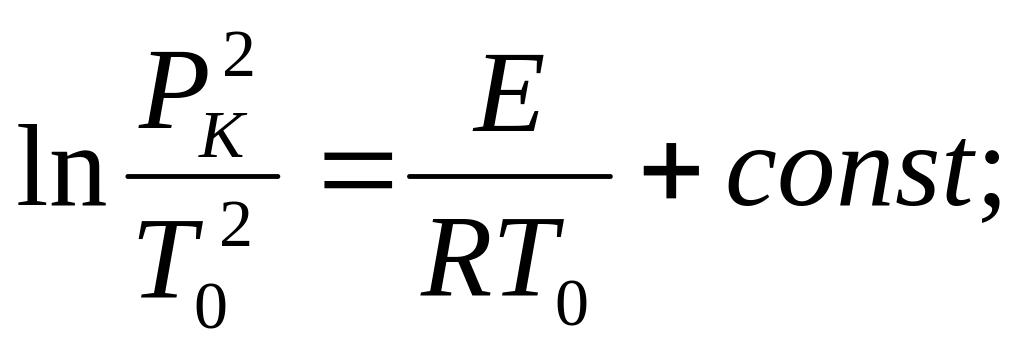 (2.38)
(2.38)
![]()
где через Pk обозначено давление, соответствующее критическому условию самовоспламенения.
Это соотношение, которое называется соотношением Н.Н. Семенова, устанавливает связь между Рк и То на границе, В системе координат Рк и То эта зависимость дает кривую, ограничивающую область взрыва (рис.2.4). Аналогичные зависимости можно установить между составом смеси и температурой при постоянном - давлении, а также между критическим давлением и составом смеси при постоянном значении Т1 (практически ~ТО ).
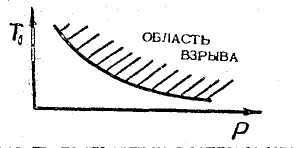
Рис.2.4. Зависимость температуры воспламенения Tj м давления Р при заданном постоянном начальном составе смеси
