
- •Общая и неорганическая химия
- •Часть 1 общие вопросы химии
- •Содержание
- •Введение ..………………………………………………………..29
- •7.5 Расчёт концентраций ионов в растворах
- •Основные химические понятия
- •Основные классы неорганических соединений
- •2.1 Введение
- •2.2 Оксиды
- •2.3 Основания
- •2.4 Кислоты
- •2.4.1 Классификация кислот
- •2.4.2 Номенклатура кислот и их солей
- •Продолжение таблицы 2.1
- •2.5 Соли
- •2.5.1 Номенклатура средних, кислых и основных солей
- •2.5.2 Солеобразные оксиды
- •2.5.3 Диссоциация солей в водных растворах
- •Стехиометрические законы химии
- •Типы химических реакций
- •4.1 Введение
- •4.2 Реакции ионного обмена
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •4.3.2 Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
- •2 Cu(oh)2 Cu2o hcho co2
- •Понятие о химическом равновесии
- •Количественной характеристикой системы в состоянии химического равновесия является константа равновесия k.
- •5.2 Смещение химического равновесия. Принцип Ле-Шателье
- •5.3 Основные типы задач на химическое равновесие
- •Общие свойства растворов
- •6.1 Характеристика растворов. Процесс растворения
- •6.2 Способы выражения концентрации растворов
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •6.3 Растворимость
- •Растворы электролитов
- •7.1 Основные положения теории электролитической диссоциации
- •7.2 Степень диссоциации
- •7.3 Константа диссоциации
- •7.4 Расчёт концентраций ионов в растворах сильных электролитов
- •7.5 Расчёт концентраций ионов в растворах слабых электролитов
- •7.6 Закон разбавления Оствальда
- •7.7 Диссоциация воды. Водородный показатель
- •7.8 Понятие о буферных растворах
- •7.9 Произведение растворимости
- •0,1 Моль/л 0,1
- •7.10 Равновесия в реакциях ионного обмена
- •Гидролиз солей
- •8.1 Общие представления о гидролизе солей
- •8.2 Константа гидролиза
- •8.3 Степень гидролиза соли; её связь с константой гидролиза
- •8.4 Гидролиз солей, образованных многозарядными катионами и анионами
- •8.5 Смещение равновесия гидролиза
- •8.6 Соли, взаимно усиливающие гидролиз друг друга
- •8.7 Кислые гидролизующиеся соли
- •Электрохимические процессы
- •9.1 Понятие об электродном потенциале
- •9.2 Понятие о гальваническом элементе
- •9.3 Теория электродных потенциалов; уравнение Нернста
- •9.4 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •9.5 Электролиз
- •9.5.1 Электролиз расплавов
- •9.5.2 Электролиз водных растворов
- •9.5.3 Применение электролиза в промышленности
- •9.6 Понятие о контактной коррозии металлов
- •Литература
- •Часть 1 Общие вопросы химии
7.4 Расчёт концентраций ионов в растворах сильных электролитов
Сильные электролиты диссоциируют полностью и необратимо, в их растворах содержатся только ионы, и нет непродиссоциировавших молекул. Расчёт концентраций ионов в таких растворах не отличается от расчётов для любых других реакций, протекающих необратимо.
Пример 7.1 Рассчитать молярную концентрацию ионов алюминия и сульфат-ионов в 0,2 М растворе сульфата алюминия.
Из уравнения необратимого процесса диссоциации сульфата алюминия Al2(SO4)3 2 Al3+ + 3 SO42– видно, что из одного моля сульфата алюминия получается 2 моль ионов Al3+ и 3 моль ионов SO42– . Следовательно, молярная концентрация ионов Al3+ в два раза больше молярной концентрации Al2(SO4)3:
C(Al3+) = 2·C(Al2(SO4)3) = 2·0,2 моль/л = 0,4 моль/л.
Молярная концентрация ионов SO42– в 3 раза больше молярной концентрации Al2(SO4)3: C(SO42–) = 3·C(Al2(SO4)3) = 3·0,2 моль/л = 0,6 моль/л.
Пример 7.2 Рассчитать молярную концентрацию серной кислоты в растворе, если известно, что концентрация ионов водорода в этом растворе равна 0,02 моль/л.
Серную кислоту в очень разбавленных растворах можно считать сильным электролитом, каждая молекула которого необратимо и полностью диссоциирует на 2 иона водорода и один сульфат-ион: H2SO4 2 H+ + SO42–. Из уравнения процесса диссоциации видно, что число моль ионов водорода в растворе после диссоциации кислоты будет в два раза больше, чем число моль молекул H2SO4. Следовательно, молярная концентрация H2SO4 будет в два раза меньше молярной концентрации ионов H+ : C(H2SO4) = ½ C(H+) = ½ · 0,02 моль/л = 0,01 моль/л.
7.5 Расчёт концентраций ионов в растворах слабых электролитов
Расчёт концентраций ионов в растворах слабых электролитов сводится к решению задачи на химическое равновесие для того случая, когда известна константа равновесия и необходимо найти равновесные концентрации веществ, участвующих в реакции.
Пример 7.3 Рассчитать концентрацию ионов водорода в растворе слабой одноосновной кислоты HA, молярная концентрация которой равна C0 моль/л, и константа диссоциации равна K .
Пусть кислоты продиссоциировало x моль/л, тогда из уравнения процесса диссоциации HA ⇆ H+ + A– следует, что в результате диссоциации образовалось x моль/л ионов H+, x моль/л ионов A–, и к моменту наступления равновесия осталось в непродиссоциированом состоянии (C0-x) моль/л кислоты HA. Таким образом, равновесные концентрации всех частиц будут следующими:
С(H+) = x моль/л; С(A–) = x моль/л; С(HA) = C0-x моль/л.
Далее необходимо подставить выраженные через x «икс» значения равновесных концентраций в выражение константы диссоциации.
(7.4)

Концентрацию ионов водорода, равную x, можно найти, решая полученное квадратное уравнение относительно x. Расчёт можно значительно упростить, пренебрегая «иксом» в знаменателе полученного выражения. Это можно сделать в том случае, если электролит очень слабый, и вследствие его очень малой диссоциации x стремится к нулю. При решении задач общей и неорганической химии «иксом» можно пренебречь, если выполняется условие K/C0 < 10–2; допускаемая при этом погрешность расчёта не превышает 1-2 % . При решении задач аналитической химии, где требуется большая точность, «иксом» пренебрегают при выполнении условия K/C0 < 10–4 . В случае пренебрежения «иксом» в знаменателе полученного выражения, оно принимает следующий вид:
, (7.5)
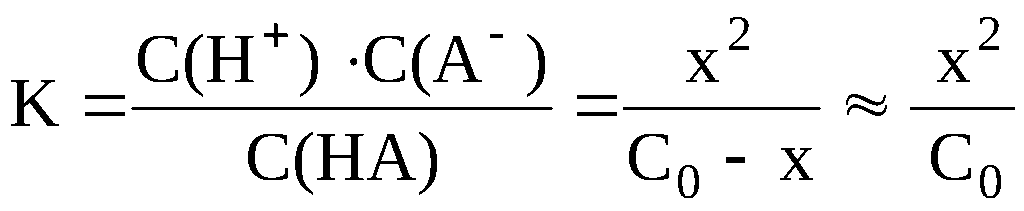
о![]() ткуда
ткуда
Таким образом, концентрацию ионов водорода в растворе слабой одноосновной кислоты можно рассчитать по следующей приближённой формуле:
![]()
. (7.6)
Концентрацию ионов OH– в растворе слабого основания можно рассчитать по аналогичной формуле
.![]() (7.7)
(7.7)
Следует ещё раз подчеркнуть, что формулы 7.6 и 7.7 являются приближёнными, вследствие чего пользоваться ими можно только при выполнении условия K/C < 10–2 . Если это условие не выполняется, нужно решать квадратное уравнение 7.4.
Пример 7.4 Рассчитать концентрации ионов водорода, дигидрофосфат-, гидрофосфат- и фосфат-ионов в 0,1 М растворе фосфорной кислоты. Константы диссоциации фосфорной кислоты: K1 = 7,5·10–3, K2 = 6,3·10–8, K3 = 1,3·10–12.
Строго говоря, общая концентрация ионов водорода в растворе слабой многоосновной кислоты равна сумме концентраций ионов H+, образовавшихся на каждой стадии диссоциации. Например, для фосфорной кислоты
C(H+)общая = C(H+)по 1 стадии + C(H+)по 2 стадии + C(H+)по 3 стадии .
Однако, в связи с тем, что диссоциация слабых электролитов протекает преимущественно по первой стадии, а по второй и последующим стадиям – лишь в незначительной степени, то C(H+)по 2 стадии 0, C(H+)по 3 стадии 0. Поэтому, допустимо считать, что что общая концентрация ионов водорода в растворе слабой многоосновной кислоты приблизительно равна концентрации ионов водорода, образовавшихся в результате диссоциации кислоты по первой стадии.
C(H+)общая C(H+)по 1 стадии
Пусть фосфорной кислоты продиссоциировало по первой стадии x моль/л, тогда из уравнения диссоциации H3PO4 ⇆ H+ + H2PO4– следует, что в результате диссоциации образовалось x моль/л ионов H+ и x моль/л ионов H2PO4– ; к моменту наступления равновесия в недиссоциированном состоянии осталось (0,1-x) моль/л H3PO4. Таким образом, равновесные концентрации всех частиц будут следующими: С(H+) = x моль/л; С(H2PO4–) = x моль/л ; С(H3PO4) = (0,1-x) моль/л.
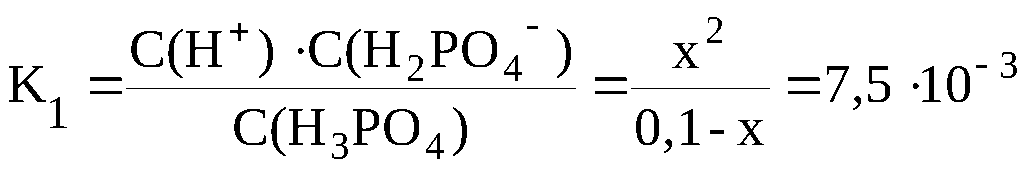
В данном случае пренебрегать «иксом» в знаменателе полученного уравнения нельзя, поскольку условие K/C < 10–2 не выполняется:
K1/C = 7,5·10–3 / 0,1 = 7,5·10–2 > 10–2 .
Поэтому x находится решением квадратного уравнения.
x2 + 7,5·10–3·x - 7,5·10–4 = 0
Из двух корней этого уравнения (x1 = -3,139·10–3; x2 = 2,389·10–2) физический смысл имеет второй корень. Таким образом, С(H+) = С(H2PO4–) ≈ 0,024 моль/л.
Поскольку гидрофосфат-ионы HPO42– образуются в результате диссоциации кислоты по второй стадии, для расчёта их концентрации необходимо воспользоваться выражением константы для второй стадии диссоциации фосфорной кислоты H2PO4– ⇆ H+ + HPO42–. Здесь важно понимать, что в выражение константы диссоциации любой стадии входят общие концентрации ионов, находящихся в растворе. Общая концентрация ионов водорода была найдена в результате расчёта по первой стадии, причём C(H+) = С(H2PO4–). Поэтому концентрация гидрофосфат-ионов оказывается численно равной второй константе диссоциации.

(моль/л)
Концентрацию фосфат-ионов легко найти, подставляя в выражение третьей константы диссоциации найденные значения С(H+) и С(HPO42–).

С(PO43–) = 3,43·10–18 моль/л
