
- •Общая и неорганическая химия
- •Часть 1 общие вопросы химии
- •Содержание
- •Введение ..………………………………………………………..29
- •7.5 Расчёт концентраций ионов в растворах
- •Основные химические понятия
- •Основные классы неорганических соединений
- •2.1 Введение
- •2.2 Оксиды
- •2.3 Основания
- •2.4 Кислоты
- •2.4.1 Классификация кислот
- •2.4.2 Номенклатура кислот и их солей
- •Продолжение таблицы 2.1
- •2.5 Соли
- •2.5.1 Номенклатура средних, кислых и основных солей
- •2.5.2 Солеобразные оксиды
- •2.5.3 Диссоциация солей в водных растворах
- •Стехиометрические законы химии
- •Типы химических реакций
- •4.1 Введение
- •4.2 Реакции ионного обмена
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •4.3.2 Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
- •2 Cu(oh)2 Cu2o hcho co2
- •Понятие о химическом равновесии
- •Количественной характеристикой системы в состоянии химического равновесия является константа равновесия k.
- •5.2 Смещение химического равновесия. Принцип Ле-Шателье
- •5.3 Основные типы задач на химическое равновесие
- •Общие свойства растворов
- •6.1 Характеристика растворов. Процесс растворения
- •6.2 Способы выражения концентрации растворов
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •6.3 Растворимость
- •Растворы электролитов
- •7.1 Основные положения теории электролитической диссоциации
- •7.2 Степень диссоциации
- •7.3 Константа диссоциации
- •7.4 Расчёт концентраций ионов в растворах сильных электролитов
- •7.5 Расчёт концентраций ионов в растворах слабых электролитов
- •7.6 Закон разбавления Оствальда
- •7.7 Диссоциация воды. Водородный показатель
- •7.8 Понятие о буферных растворах
- •7.9 Произведение растворимости
- •0,1 Моль/л 0,1
- •7.10 Равновесия в реакциях ионного обмена
- •Гидролиз солей
- •8.1 Общие представления о гидролизе солей
- •8.2 Константа гидролиза
- •8.3 Степень гидролиза соли; её связь с константой гидролиза
- •8.4 Гидролиз солей, образованных многозарядными катионами и анионами
- •8.5 Смещение равновесия гидролиза
- •8.6 Соли, взаимно усиливающие гидролиз друг друга
- •8.7 Кислые гидролизующиеся соли
- •Электрохимические процессы
- •9.1 Понятие об электродном потенциале
- •9.2 Понятие о гальваническом элементе
- •9.3 Теория электродных потенциалов; уравнение Нернста
- •9.4 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •9.5 Электролиз
- •9.5.1 Электролиз расплавов
- •9.5.2 Электролиз водных растворов
- •9.5.3 Применение электролиза в промышленности
- •9.6 Понятие о контактной коррозии металлов
- •Литература
- •Часть 1 Общие вопросы химии
6.2 Способы выражения концентрации растворов
Под концентрацией раствора понимают содержание растворённого вещества в определённом объёме или массе раствора или растворителя. Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Существует много различных способов выражения концентрации растворов. Один из наиболее употребительных в химии и технике способов – это выражение концентрации растворённого вещества в виде массовой доли (процентной концентрации).
Массовая доля (процентная концентрация) показывает, сколько массовых частей растворённого вещества содержится в 100 массовых частях раствора. Если в качестве единицы массы выбрать грамм, то определение массовой доли можно также записать следующим образом: массовая доля (процентная концентрация) показывает, сколько граммов растворённого вещества содержится в 100 граммах раствора.
![]()
(6.1 а)
В формуле 6.1 а ω(X) – массовая доля растворённого вещества X;
m(X) – масса растворённого вещества X;
mраствора – масса раствора.
Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
![]()
(6.1 б)
Понятно, что в этом случае, 30% раствору, например, будет соответствовать массовая доля ω = 0,3 .
Другим важнейшим способом выражения содержания растворённого вещества в растворе является молярная концентрация (молярность). Молярная концентрация показывает, сколько моль растворённого вещества содержится в 1 литре (т.е. 1 дм3) раствора.
![]() (6.2)
(6.2)
В формуле 6.2 C(X) – молярная концентрация вещества X в растворе (моль/л); n(X) – количество растворённого вещества Х (моль);
Vраствора – объём раствора (л).
В технологических регламентах производственных процессов концентрацию растворов очень часто выражают массой растворённого вещества содержащегося в 1 литре раствора. Так, запись «концентрация сульфата натрия в растворе равна 25 г/л» означает, что в 1 литре раствора содержится 25 граммов растворённого Na2SO4.
Пример 6.1 Рассчитать молярную концентрацию 10% раствора ортофосфорной кислоты; плотность раствора 1,1 г/мл.
Массовая доля раствора 10 % означает, что в 100 граммах раствора содержится 10 граммов H3PO4. Следовательно,


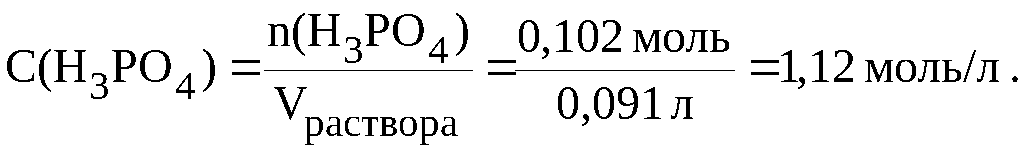
Этот
же расчёт можно выполнить и другим
способом.

При выполнении расчёта вторым способом массовую долю следует выражать не в процентах, а в долях единицы, а плотность в г/л (1 г/мл = 1000 г/л).
6.3 Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе. Количественной мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора. Поэтому растворимость может быть выражена в виде процентной, молярной концентрации растворённого вещества в насыщенном растворе. Очень часто растворимость выражают также числом граммов растворённого вещества, насыщающих 100 граммов растворителя (например, воды).
Растворимость разных веществ в воде может очень сильно различаться. Если в 100 граммах воды растворяется более 10 граммов вещества, то такое вещество считается хорошо растворимым; если растворяется менее 1 грамма вещества – малорастворимым, если менее 0,01 грамма вещества – практически нерастворимым. Следует, отметить, что абсолютно нерастворимых веществ не существует.
Принципы, позволяющие количественно предсказать растворимость вещества, в настоящее время неизвестны. Однако ещё со времён алхимиков известно правило «подобное растворяется в подобном», которое отражает тот факт, что вещества, состоящие из полярных молекул, и вещества с ионным типом связи (HCl, NaCl, H2SO4, K2SO4) лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества (например, галогены) – в неполярных растворителях (бензол, сероуглерод и т.п.).
Растворение большинства твёрдых тел сопровождается тепловым эффектом: кристалл + растворитель ⇆ раствор Q .
Применяя принцип Ле-Шателье к равновесию растворения, легко спрогнозировать, что если вещество растворяется с поглощением тепла, то увеличение температуры приведёт к увеличению растворимости. Если же образование раствора сопровождается выделением тепловой энергии, растворимость с ростом температуры уменьшается.
Растворение газов в воде представляет собой экзотермический процесс, поэтому растворимость газов с повышением температуры уменьшается. Так, кипячением воды можно удалить растворённый в ней воздух, сероводород, аммиак и другие газы.
Если растворимость вещества уменьшается при понижении температуры, то при охлаждении насыщенных растворов избыток растворённого вещества обычно выделяется. Однако, если охлаждение проводить осторожно и медленно, не допуская попадания в раствор твёрдых частиц извне, то выделения избытка растворённого вещества может не произойти. В этом случае образуется раствор, содержащий значительно больше растворённого вещества, чем его требуется для насыщения при данной температуре. Такие растворы называются пересыщенными. В спокойном состоянии они могут длительное время оставаться без изменения. Но при попадании в пересыщенный раствор извне твёрдых частиц растворённого вещества и при встряхивании раствора, весь избыток растворённого вещества быстро выкристаллизовывается.
Л Е К Ц И Я 7
