
- •5. Периодический закон и его сущность.
- •8. Скорость химической реакции.
- •7. Тепловой эффект химической реакции.
- •14. Электролитическая диссоциация
- •13. Водородная связь и свойства воды.
- •12. Способы выражения состава растворов.
- •25. Гальвонические элементы. Элемент Даниоля-Якоби. Эдс гальвонического элемента.
Электрохимическая
коррозия Ме
– самопроизвольное разрушение Ме в
средах проводящих эл. ток. 1.Коррозия
при контакте двух Ме. Ме1/Ме2(электролит)
EМе1(n+)/Me2(0)
< E0Me1(0)/Me2(n+) Me10
> сильный восст-ль, чем Ме2,
т. е. Ме1
> более активен. (-)A:
Me10
– ne
= Me1n+
Ок-ли,
вызывающие электрохим. коррозию. 1).рН=7 а).2H2O
+ 2e
= H2
+ 2OH-
E
= -0,41B б).O2
+ 2H2O
+ 4e
= 4OH-
E0
= +0,40B pH=7
EE0
= 0,40 +(0,059/4)*lg(Po2[H2O]2/[OH-]4)
= +0,82 В
нейтральной среде ок-лем, вызываемым
электрохим. коррозию явл. кислород,
растворенный в воде. 2).рН<7
В кислой среде кинетически более
выгодно восст-е ионов водорода. 2H+
+ 2e
= H20 Ок-ль,
вызываемый электрохим. коррозию – ион
водорода. Причиной
электрохим. коррозии явл. возникновение
локального гальвонического элемента
вследствие разности активности Ме.
Чтобы избежать разрушения Ме не следует
допускать его контакт с менее активным.
Если сплав Ме представляет собой
металлическую смесь, то в нем возникают
микрогальвонические элементы. В
присутствии электролита более активный
Ме будет разрушаться, сл-но, чистые Ме
и однородные сплавы менее подвержены
коррозии. 3.Коррозия
при холодной механической обработке
(сверление, штамповка). При
ней часть энергии частично расходуется
на увеличение поверхностной энергии
обрабатываемого участка. Поэтому
частицы на обрабатываемых участках
более химически активны, им проще
перейти в р-р. Обработанные участки
выполняют роль анода, соседние участки
– роль катода. Поэтому на обработанной
поверхности Ме подвергается разрушению. 4.Коррозия
при неодинаковой аэрации (доступе
воздуха). Коррозия
протекает в результате того, что у
поверхности одного из электродов,
сделанных из одного и того же материала,
протекает реакция O2
+ 2H2O
+ 4e
= 4OH-
(за счет подачи кислорода) и образуется
газовый электрод. Поскольку для
функционирования этого электрода
необходимы электроны, они берутся из
на соседних участках, выполняющих роль
анода. Защита
от коррозии. 1).неметаллич.
покрытия. Покрытия
наносят для исключения контакта
металлич. элементов с окружающей средой
(краски, лаки, эмали), а также хим.
покрытия, полученные путем оксидирования
пов-ти (при воздействии сильных
окислителей KMnO4). 2).металлич.
покрытия. Металлич.
изделия покрывают слоями более
благородных Ме (хромирование,
никелирование, цинкование (Zn/Fe),
лужение (Sn/Fe)). 3).Метод
протекторов. Участок
защищаемого металлич. изделия соединяется
с протектором путем более акт. Ме. В
присутствии электролита протектор
подвергается разрушению. 4).Катодная
защита. Защищаемая
деталь присоединяется к “-” полюсу
источника постоянного тока и становится
катодом. В качестве анода используют
ненужные куски железа, присоединенные
к “+” полюсу источника тока. Анод при
этом разрушается, а на катоде, в
зависимости от среды, идет либо процесс
восст-я ионов водорода, либо восст-я
молекул водорода.
26.
Аккумуляторы
– обратимые источники энергии. После
зарядки их можно многократно использовать.
Свинцовый
(кислотный)
аккумулятор:
электроды
свинцового аккумулятора изготовлены
из свинцовых решетчатых пластин,
погруженных в р-р серной кислоты с
конц-ей 30-40% (при этой конц-ии теплопроводность
max). Работа
ак-ра (разрядка). Pb,
PbO2,
H2SO4(30-40%) (-)A:
(Pb0
– 2e = Pb2+) Pb0
+ SO42-
- 2e = PbSO4 (+)K:
(Pb4+
+ 2e = Pb2+) PbO2
+ SO42-
+ 4H+
+ 2e = 2PbSO4
+ 2H2O Pb
+ SO42-
+ PbO2
+ SO42-
+ 4H+
= 2PbSO4
+ 2H2O Pb
+ PbO2
+ 2H2SO4
= 2PbSO4
+ 2H2O ЭДС
такого аккумулятора составляет ~ 2B.
В
процессе работы ак-ра расходуются в-ва
и его составляющие и через некоторое
время необходима зарядка. Для этого
ак-р подклячают к источнику постоянного
тока. Ток протекает в обратном направлении,
чем при работе ак-ра. Зарядка. PbSO4,
H2SO4(разб.)
AK,
KA (+)A:
Pb2+
- 2e = Pb4+ PbSO4
+ 2H2O
– 2e = PbO2
+ SO42-
+ 4H+ (-)K:
H+(H2SO4p)
Pb2+(PbSO4) E02H(+)/H2
= 0B
E0Pb(2+)/Pb
= -0,13B Однако,
поскольку PB2+
входит в состав малорастворимой соли,
то его конц-ция сильно отличается от
стандартной. EPb(2+)/Pb
E0Pb(2+)/Pb
=< -0,13B Из
сравнения электродных потенциалов
следует, что ион водорода более сильный
ок-ль, чем Pb2+.
Однако реально на катоде идет процесс
восст-я ионов свинца. Это связано с
явлением, кот. наз. перенапряжение
выделение молекулярного водорода:
различные
Ме обладают различной каталитической
активностью по отношению к процессу
выделения молекулярного водорода. Одни
способствуют этому (например платина),
а другие тормозят (свинец). Особенно
велико перенапряжение на свинце в
серной кислоте, оно составляет –1,3В. E2H(+)/H2
= -1,3B Из-за
кинетических трудностей выделения
молекул. водорода Pb2+
оказывается более сильным ок-лем, чем
ион водорода. (-)K:
Pb2+
+ 2e = Pb0 PbSO4
+ 2e = Pb0
+ SO42- PbSO4
+ 2H2O
= Pb
+ PO2
+ 2H2SO4 Топливный
элемент — электрохимическое устройство,
подобное гальваническому
элементу,
но отличающееся от него тем, что вещества
для электрохимической реакции
подаются в него извне[1] —
в отличие от ограниченного количества
энергии, запасенного вгальваническом
элементе или аккумуляторе. Топливные
элементы осуществляют прямое превращение
энергии топлива в электричество минуя
малоэффективные, идущие с большими
потерями, процессы горения. Это
электрохимическое устройство в
результате высокоэффективного
«холодного» горения топлива непосредственно
вырабатывает электроэнергию. Щелочные
топливные элементы
потребляют водород и чистый кислород,
и производят воду, тепло, и электричество.
Они являются самыми эффективными из
топливных элементов, коэффициент
полезного действия их
доходит до 70 %.
27.
Электролиз
расплавов и растворов. Законы электролиза. Электролиз
– процесс
отдельного ок-я, восст-я на электродах,
осущ. за счет протекания постоянного
эл. тока от внешнего источника. Если в
гальвоническом элементе происходит
преобразование энергии химической
р-ции в электрическую, то при электролизе
эл. энергия используется для осущ-ния
хим. процесса, т. к. ток протекает в
обратном направлении, нежели в
гальвоническом элементе, то на аноде
по прежнему идет процесс ок-я, но это
уже “+” электрод, а катод соответственно
“-”. Рассмотрим электролиз расплавов
с энертными (угольными и платиновыми)
электродами. NaCL(тв)
t
NaCL
Na+
+ CL-
(+)A:
2CL – 2e = CL20
E0
= +1,36B (-)K:
Na+
+ e = Na0
E0
= -2,71B
E0
= E0В-Я
– E0О-Я
= -2,71 – 1,36 < 0 NaCL,
KCL (+)A:
2CL – 2e = CL20 (-)K:
1).Na+
+ e = Na0 2).K+
+ e = K0
E0Na(+)/Na(0)
>
E0K(+)/K(0)
(-2,71B
> -2,92B), сл-но,
Na+
> более
сильный
ок-ль,
чем
K+
Na2SO4
+ H2O (+)A:
1).2SO42-
– 2e = S2O82-
E0
= +2,01B
2).2H2O
– 4e = O2
+ 4H+
pH=0
E0
= +1,23B pH=7
E = E0 + (0,059/n)*lg([Ox]/[Red]) = 1,23 +
(0,059/4)*lg(Po2[H+]4/[H2O]2)
= 1,23 + (0,059/4)*lg[H+]
= 1,23 + 0,059*lg[H+]
= 1,23 – 0,059pH = 0,82B
вода
явл.
> сильным
восст-лем, чем сульфат ион, поэтому на
аноде идет процесс ок-я воды. (+)A:
1).Na+
+ e = Na0
E0
= -2,71B
2).2H2O
+ 2e = H20
+ OH-
pH=7
E0
= -0,41B Вода
> сильный ок-ль, чем ион натрия, т. е.
на катоде протекает процесс восст-я
воды. Таким образом электролиз р-ра
сульфата натрия сводится к электролизу
воды. CuSO4
+ H2O (+)A:
------и-------и------- (-)K:
1).Cu2+
+2e = Cu0
E0
= +0,34B 2).CuSO4
+ H2O
= (CuOH)2SO4
+ H2SO4
H+(H2SO4) Поскольку
среда слабо-кислая, то E2H(+)/H2
E02H(+)/H2
< 0B
(-0,06 до –0,36) Из
сравнения потенциалов восс-я ионов
водорода и ионов меди следует, что Cu2+
> сильный ок-ль, чем H+,
поэтому на катоде будет выделяться Cu. При
электролизе сульфатов Ме средней
активности (Cr,
Fe,
Ni,
K)
на катоде будут протекать два конкурирующих
процесса. При электролизе р-ров на аноде
окисляются восстановленные формы
систем с наименьшим потенциалом, на
катоде восстанавливаются окисленные
формы систем с наибольшим потенциалом. Законы
электролиза: 1).Масса
в-ва, образующегося при электролизе
(отдельно на аноде и катоде), пропорциональна
количеству электричества, прошедшего
через р-р. 2).Массы
в-в, образующихся при пропускании одного
и того же количества электричества
пропорциональны их эквивалентным
массам. m=kq
k=Эm/F
m=Эm*q/F
m/Эm=q/F
q=F
число Эm
– это количество электричества,
обуславливающие превращение одной
эквивалентной массы в-ва.
25.
Вз-вия Ме с
растворами солей. Коррозия цинка в
растворе карбоната калия. Возможные
вз-вия в системах: (Zn+ZnCL2+H2O),
(Fe+CuSO4+H2O),
(Al+Na2S+H2O),
(Al+Na2CO3+H2O). Zn
+ CuCL2
+ H2O Zn
+ MgCL2
+ H2O Zn
+ NiCL2
+ H2O Zn0
– 2e = Zn2+ Возможные
ок-ли: 1).MeCL2
Me2+
2).MeCL2
+ H2O
= MeOHCL + HCL H+(HCL) Однако,
поскольку гидролиз частичный, то его
степень не велика, поэтому концентрация
ионов водорода значительно < 1, т. е.
условия не стандартные. PH
от 1 до 6, Е=(от -0,06 до 0,36)В 1.
Zn + CuCL2
+ H2O-? E0Cu(2+)/Cu
= +0,34B E02H(2+)/H2
= (-0,06 до -0,36)B
Си2+
> сильный ок-ль, чем H+ 2Zn
+ 2CuCL2
= 2ZnCL2
+ 4Cu 2.
Zn
+ MgCL2
+ H2O-? E0Mg(2+)/Mg
= -2,37B E02H(2+)/H2
= (-0,06 до -0,36)B MgCL2
+ H2O
= MgOHCL
+ HCL Zn
+ 2HCL = ZnCL2
+ H2 3.
Zn + NiCL2
+ H2O-? E0Ni(2+)/Ni
= -0,25B E02H(2+)/H2
= (-0,06 до -0,36)B
Ni2+~
H+
идут два конкурирующих процесса:
вытеснение менее акт. Ме из соли и вз-вие
с продуктами гидролиза. 1).NiCL2
+ H2O
= NiOHCL
+ HCL Zn
+ HCL
= ZnCL2
+ H2 2).Zn
+ NiCL2
+ ZnCL2
+ Ni
Zn
+ ZnSO4 + H2O -? 2ZnSO4
+ 2H2O
= (ZnOH)2SO4
+ H2SO4 Zn
+ H2SO4(p)
= ZnSO4
+ H2 2ZnSO4
+ Zn + 2H2O
+ H2SO4
= (ZnOH)2SO4
+ H2
+ H2SO4 Zn
+ Zn SO4
+ 2H2O
= (ZnOH)2
+ H2
Zn
+ Na2CO3 + H2O -? Na2CO3
+ H2O
= NaHCO3
+ NaOH Zn
+ NaOH + H2O
= Na2[Zn(OH)4]
+ H2 2Na2CO3
+ 2H2O
+ Zn + 2NaOH + H2O
= 2NaHCO3
+ 2NaOH + Na2[Zn(OH)4]
+ H2 Zn
+ 2Na2CO3
+ 4H2O
= Na2[Zn(OH)4]
+ 2NaHCO3
+ H2O
Zn0
+ Cu2+
= Zn2+
+ Cu0 Zn0
– восст-ль, Cu2+
- ок-ль Электроны
самопроизвольно переходят от восст-ля
к ок-лю. Zn0
– 2e = Zn2+ Cu2+
+ 2e = Cu0 Если
же процессы ок-я и восст-я пространственно
разделить и заставить переходить
электроны от восст-ля к ок-лю по проводнику
эл. тока, то мы получим устройство, наз.
гальвоническим
элементом. Гальвонич.
элемент Даниоля-Якоби. Комбинация
ионного проводника и электронного
проводника наз. электродом. E0Zn(2+)/Zn
= -0,76B E0Cu(2+)/Cu
= +0,34B E0Zn(2+)/Zn
< E0Cu(2+)/Cu
Zn0
> сильный восст-ль, чем Cu0 (-)A:
Zn0
– 2e
= Zn2+ Электрод,
на котором идет процесс ок-я, наз. анодом.
(+)K:
Cu2+
+ 2e
= Cu0 Электрод,
на котором идет процесс восст-я, наз.
катодом. Чтобы
ликвидировать избыток “+” заряда
цинкового электрода, сульфат ионы
устремляются к электроду. E0
= E0В-Я
– E0О-Я
= E0K
– E0A
= ЭДС ЭДС
= 0,34 +0,76 = 1,1В Это
пример гальвонического элемента с акт.
эектродами, поскольку в процессе реакции
участвует материал анода, т. е. происходит
его анодное разрушение. Гальвонич.
элемент с энертными электродами. E0Sn(4+)/Sn(2+)
= +0,15B < E0Fe(3+)/Fe(2+)
= +0,77B (-)A:
Sn2+
- 2e = Sn4+ (+)K:
Fe3+
+ e = Fe2+ ЭДС
= E0K
– E0A
= 0,77-0,15 = +0,62B Концентрационные
гальвонич. элементы. Эти
элементы работают за счет разности
концентраций одного и того же элемента.
Т. к. согласно ур-нию Нернста электродный
потенциал зависит от концентраций, то
электрод с меньшим потенциалом будет
анодом. Гальвонический
элемент – устройство
преобразующее энергию химической
реакции в электрическую. Т. к. при работе
гальвонического элемента происходит
полное расходование ок-ля, то он теряет
работоспособность и явл. необратимым
источником эл. тока.
23.
Вз-вие
Ме с водой. H2O
2H2O
+ 2e
= H2
+ 2OH- Поскольку
р-ция среды в водном р-ре нейтральна,
т. е. рН=7 условия отличаются стандартных
([H+]=1моль/л,
рН=0).Электродный потенциал восстановления
ионов водорода зависит от их концентрации. E2Н(+)/
Н2 =
-0б059рН
E2Н(+)/
Н2 =
- 0б41В Сл-но,
с водой должны реагировать Ме, для кот.
стандартный электродный потенциал <
-0,41B.
Однако в реальных условиях с водой
вз-вуют крайне ограниченное число Ме,
а именно: щелочные и щел.-земельные,
лантоноиды, актиоиды. Связано это прежде
всего с состоянием пов-ти. Вследствие
вз-вия Ме с кислородом их по-ть покрывается
оксидными слоями. Эти оксиды имеют
амфотерный или основной характер и
хорошо растворяются в кислотах, поэтому
мы не рассматриваем состояние пов-ти
в случае кислот. При
вз-вии с водой актиоидов и лантоноидов
обр-ся малорастворимые гидроксиды.
Однако их структура такова, что доступ
воды к пов-ти Ме не прекращается. La
+ H2O
= La(OH)3
+ H2 При
создании более жестких условий
(кипечение,измельчение) с водой могут
вз-вать Mg,
Fe, Zn. Вз-вие
Ме с растворами щелочей. H2O
+ щелочь 2H2O
+ 2e
= H2
+2OH-
pH=14(среда
щелочная) EMe(n+)/Me<-0,83B
т. е. с водой должны реагировать Ме, для
кот. электродный потенциал <-0,83B.
Это связано сдвумя причинами: 1).В
водных р-рах щелочей могут растворяться
только амфотерные оксиды, поэтому
только Ме, способные к обр-нию амф-ных
оксидов могут реагировать со щелочами. 2).Zn2+
+ 2OH-
= Zn(OH)2 Zn(OH)2
+ 2OH-
= [Zn(OH)4]2- т.
е. в щелочном р-ре Zn
переходит в [Zn(OH)4]2-,
сл-но, концентрация [Zn2+]
очень мала, сл-но, условия не стандартные.
[Zn2+]<<1моль/л EМе(n+)/
Ме(0)
=
E0Ме(n+)/
Ме(0)
+
(0,059/n)*lg[Men+]=<<-0.76B EZn(n+)/
Zn(0)
-0.76B EМе(n+)/
Ме(0)
<-0,83B Be,
Zn,
Al,
Pb,
Sn
– самые распространенные ZnO
+ 2NaOH + H2O
= Na2[Zn(OH)4] Zn
+ 2H2O
= Zn(OH)4
+ H2 Zn(OH)2
+ 2NaOH = Na2[Zn(OH)4] Zn
+ 2NaOH + 2H2O
= Na2[Zn(OH)4]
+ H2






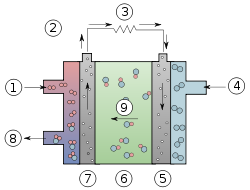 Схема
щелочного топливного элемента.
1:Водород 2:Поток электронов 3:Нагрузка
4:Кислород 5:Катод
6:Электролит 7:Анод
8:Вода 9:Гидроксид-ионы
Схема
щелочного топливного элемента.
1:Водород 2:Поток электронов 3:Нагрузка
4:Кислород 5:Катод
6:Электролит 7:Анод
8:Вода 9:Гидроксид-ионы25. Гальвонические элементы. Элемент Даниоля-Якоби. Эдс гальвонического элемента.
