
- •Раздел 6. Температура. Температурные шкалы. Датчики и приборы
- •Тема 21. Термоэлектрическая и оптическая термометрия
- •18.2. История термометра и температурных шкал.
- •18.3. Что измеряет термометр?
- •18.4. Тепловое равновесие и температура
- •18.5. Закон Бойля-Мариотта
- •18.6. Температурные шкалы.
- •18.7. Международная температурная шкала 1990 (its-90, мтш-90)
- •18.8. Классификация термометров
- •19. Термометрия. Газовая термометрия. Термометрия, основанная на тепловом расширении жидкостей и твердых тел.
- •19.1. Газовый термометр
- •19.1.1. Термометр Симона.
- •19.1.2. Манометр, заполненный маслом или ртутью.
- •19.1.3. Дифференциальный манометр.
- •19.1.4. Поправки на неидеальность газа.
- •19.2. Конденсационный термометр.
- •19.3. Дилатометрические термометры
- •19.3.1. Жидкостные стеклянные термометры
- •19.3.2. Биметаллические и дилатометрические термометры
- •20. Термометры сопротивления
- •20.1. Введение
- •20.2. Сопротивление металлов
- •20.3. Платиновые термометры.
- •20.3.1 Требования к исходному материалу.
- •20.3.2. Конструкции термометров.
- •20.3.3. Расчет температуры.
- •20.3.4. Измерение сопротивления термометра.
- •20.4. Другие типы термометров сопротивления.
- •20.4.1. Медные термометры
- •20.4.2 Никелевые термометры
- •20.5. Полупроводниковые термометры
- •20.5.1. Германиевые термометры сопротивления
- •20.5.2. Термисторы
- •20.6. Угольные термометры сопротивления
- •21. Термоэлектрическая и оптическая термометрия
- •21.1. Термоэлектрические датчики температуры. Термопары.
- •21.1.1. Материалы термопар и их конструкция
- •21.1.2. Термоэлектрические преобразователи, основные типы и области применения
- •21.1.3. Кабельные термоэлектрические преобразователи
- •21.2. Оптические пирометры
- •21.2.1. Некоторые физические положения
- •21.2.2. Принцип измерения яркостной температуры
18.5. Закон Бойля-Мариотта
Традиционный эксперимент Бойля-Мариотта дает превосходную возможность обсудить идеи, представленные выше. Система, стенки и окружение идентифицированы с воздухом в трубке, стеклянными стенками трубки и атмосферой соответственно. Удобными термодинамическими координатами являются давление p и объем V воздуха, которые нанесены на график рис. 18.12. Когда трубка с ртутью регулируется, чтобы изменить объем, необходимо выждать некоторое время, пока уровни не установятся, перед снятием показаний, что система достигла тепловое равновесие с окружением.
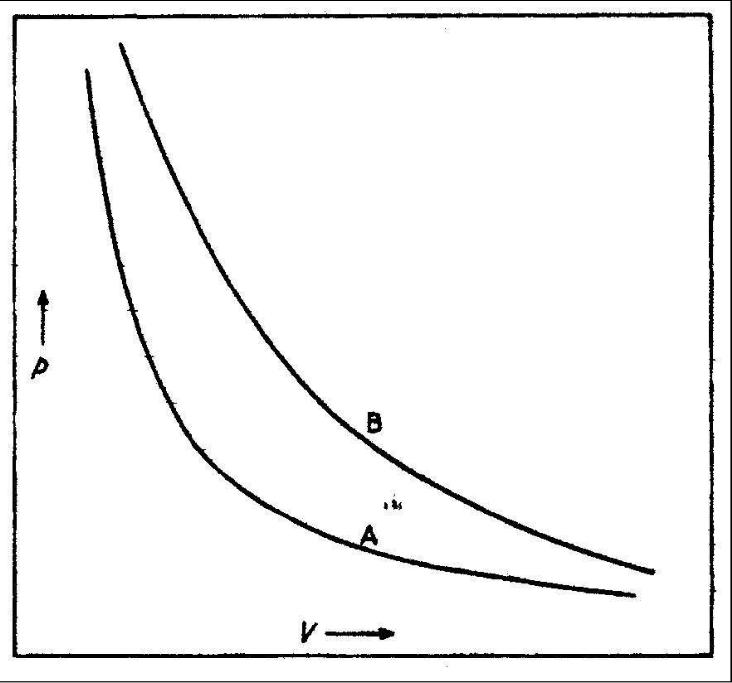
Рис. 18.12. Изотермы p − V для газа.
Следовательно, если термодинамическое состояние окружения остается постоянным в течение эксперимента (что контролируется, например, неградуированным стеклянным ртутным термометром), точки на графике представляют состояния, которые, согласно нулевому закону находятся в тепловом равновесии друг с другом. Такой процесс называется изотермическим и очевидно происходит при постоянной температуре. Линия, проведенная через эти точки на графике, показывает зависимость между двумя термодинамическими координатами - давлением и объемом при изотермических условиях и называется изотермой. Когда мы примем процедуру для того, чтобы приписывать числовые значения температуре, мы будем маркировать изотерму соответствующей температурой.
График log(p) от log(V ) является прямой линией с наклоном -1 приблизительно, что соответствует уравнению pV = const для изотермических процессов в газе. Это и есть закон Бойля-Мариотта.
Детальные исследования в широких диапазонах давлений показывают, что газы описываются законом Бойля-Мариотта довольно хорошо при низких давлениях, в то время как есть значительные отклонения от этого закона в области высоких давлений, особенно вблизи перехода в сжиженное состояние. Это и приводит к понятию идеального газа как газа, который описывается законом Бойля-Мариотта во всем диапазоне давлений и температур.
Значение произведения pV в изотермическом процессе может быть связано с физиологическим ощущением тепла. Если мы повторим вышеупомянутый эксперимент с трубкой в паровой бане, мы получаем другую изотерму B, которая пройдет всюду выше изотермы А на рис. 18.12.
Таким образом, произведение pV больше для горячей системы, чем для холодной. Выбирая различные параметры одного и того же вещества или одинаковые параметры различных веществ, можно установить множество температурных шкал. Но даже в том случае, когда численные значения температуры двух или большего числа постоянных точек на этих шкалах будут по нашему выбору выражаться одними и теми же числами, нет оснований ожидать, что шкалы совпадут при других температурах. Нет также никаких оснований предпочесть из множества шкал такого типа какую-либо одну и считать ее основной. Но, очевидно, наличие множества температурных шкал вызвало бы очень большие неудобства и было бы неудовлетворительным во многих отношениях.
Результат этого эксперимента показывает, что температура зависит от термометрических свойств рабочего тела. Эксперименты показали согласие между газовыми термометрами постоянного давления и постоянного объема, но большие различия с другими термометрами. Дальнейшие исследования показывают, что есть хорошее согласие между газовыми термометрами, использующими различные газы и что это согласие улучшается при низких давлениях. Это позволяет использовать произведение pV идеального газа как величину пропорциональную температуре.
Измерение термодинамической температуры должно быть выполнено с газом при таких условиями, что его поведения близко к поведению идеального газа. Пусть мы выбрали термометр постоянного объема, содержащий реальный газ, например азот. Предположим, что давление азота, скорректированное на расширение сосуда и т.д равно ptp, когда тепловое равновесие было достигнуто между термометром и ячейкой тройной точки. Затем сосуд помещается в тепловой контакт с системой, температура которой должна быть измерена, и фиксируется равновесное давление p.
Температура Tp рассчитывается по уравнению
 К (18.1)
К (18.1)
Заметьте, что уравнение получено из уравнения 1, при условии V = Vtp. Нижний индекс p используется, чтобы указать, что температура была рассчитана из измерений давления реального газа. Вышеупомянутая процедура повторяется с меньшим количеством азота в сосуде так, чтобы и p и ptp были меньше, и рассчитывается второе значение Tp. Дальнейшее уменьшение количества азота и повторение процедуры приводят к ряду значений Tp при более низких давлениях. Полученную зависимость можно экстраполироваться, как показано на рис. 18.13, и получить значение, соответствующее нулевому давлению:
![]() (18.2)
(18.2)
В предыдущих разделах мы заметили, что реальные газы удовлетворяют условиям закона Бойля-Мариотта при низких давлениях. Таким образом, мы должны ожидать, что реальный газ удовлетворит условиям закона Бойля-Мариотта точно в пределе нулевого давления. Значение T, полученное из уравнения (18.2) соответствует поведению идеального газа и соответствует термодинамической температуре. Заметьте, что то же самое значение T было бы получено, даже в случае различных газов, используемых в термометре (см. рис. 18.13).
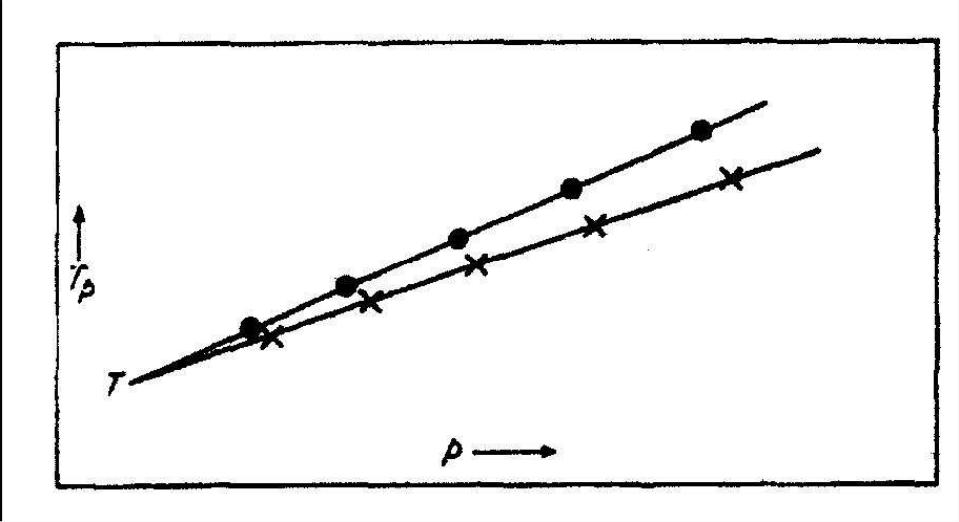
Рис. 18.13. Экстраполяция вычисленных
значений Tp при p
![]() 0 для двух разных газов.
0 для двух разных газов.
Длинная, утомительная процедура, описанная выше является очевидно неподходящей для большинства температурных измерений. Однако, она используется, чтобы определить температуры равновесных состояний кипячения и температуры замерзания некоторых веществ.
Определение температуры в терминах поведения идеального газа имеет то преимущество, что она не зависит от свойств рабочего тела. Можно показать, что температура идеального газа идентична температуре в термодинамической шкале, предложенной в 1848 Томсоном (лорд Кельвин), если используется та же самая фиксированная точка. Термодинамическая температура базируется на действии идеальной тепловой машины и независима от свойств рабочего тела.
