
- •Раздел 6. Температура. Температурные шкалы. Датчики и приборы
- •Тема 21. Термоэлектрическая и оптическая термометрия
- •18.2. История термометра и температурных шкал.
- •18.3. Что измеряет термометр?
- •18.4. Тепловое равновесие и температура
- •18.5. Закон Бойля-Мариотта
- •18.6. Температурные шкалы.
- •18.7. Международная температурная шкала 1990 (its-90, мтш-90)
- •18.8. Классификация термометров
- •19. Термометрия. Газовая термометрия. Термометрия, основанная на тепловом расширении жидкостей и твердых тел.
- •19.1. Газовый термометр
- •19.1.1. Термометр Симона.
- •19.1.2. Манометр, заполненный маслом или ртутью.
- •19.1.3. Дифференциальный манометр.
- •19.1.4. Поправки на неидеальность газа.
- •19.2. Конденсационный термометр.
- •19.3. Дилатометрические термометры
- •19.3.1. Жидкостные стеклянные термометры
- •19.3.2. Биметаллические и дилатометрические термометры
- •20. Термометры сопротивления
- •20.1. Введение
- •20.2. Сопротивление металлов
- •20.3. Платиновые термометры.
- •20.3.1 Требования к исходному материалу.
- •20.3.2. Конструкции термометров.
- •20.3.3. Расчет температуры.
- •20.3.4. Измерение сопротивления термометра.
- •20.4. Другие типы термометров сопротивления.
- •20.4.1. Медные термометры
- •20.4.2 Никелевые термометры
- •20.5. Полупроводниковые термометры
- •20.5.1. Германиевые термометры сопротивления
- •20.5.2. Термисторы
- •20.6. Угольные термометры сопротивления
- •21. Термоэлектрическая и оптическая термометрия
- •21.1. Термоэлектрические датчики температуры. Термопары.
- •21.1.1. Материалы термопар и их конструкция
- •21.1.2. Термоэлектрические преобразователи, основные типы и области применения
- •21.1.3. Кабельные термоэлектрические преобразователи
- •21.2. Оптические пирометры
- •21.2.1. Некоторые физические положения
- •21.2.2. Принцип измерения яркостной температуры
18.4. Тепловое равновесие и температура
Рассмотрим, как было достигнуто современное определение температуры и как тесно это связано с понятием идеального газа. Сделаем это на основе макроскопических наблюдений, без каких-либо предположений о внутренней структуре вещества.
В термодинамике область пространства или количество вещества, которые мы изолируем мысленно или физически и на которых мы концентрируем наше внимание, называют системой. Все вне системы, на которую может, конечно, воздействовать то, что находится снаружи, названо окружением. Система отделена от окружения стенкой, сквозь которую никакие химические реакции или массообмен не происходят, так что масса системы остается постоянной.
Чтобы описывать поведение системы и ее взаимодействий с окружением и с другими системами, мы должны определить значения некоторых величин, таких как давление, размеры и т. д. Такие величины, которых не так много и которые являются прямо наблюдаемыми, названы макроскопическими координатами. (Заметьте, что слово координата используется здесь в том же самом смысле, что и на графиках.) Другой вариант, который включает предположения о внутренней структуре вещества, должен определить координаты положений и скоростей (возможно и других) материальных точек, из которых состоит система, как в кинетической теории газов. Это - микроскопические координаты; они прямо не наблюдаемы, и их чрезвычайно много - кубический сантиметр воздуха содержит приблизительно 1019 молекул.
Исследования в физике начинаются с рассмотрения макроскопических координат, которые относятся к двум группам:
- Внешние координаты, такие как смещение, скорость и импульс системы в целом;
- Внутренние или термодинамические координаты, такие как давление и объем, которые позволяют нам описать внутреннее состояние системы.
Рассмотрите, например, сосуд, содержащий известную массу газа. Кинетическая энергия газа в целом в любой момент может быть рассчитана из наблюдений движения сосуда, но эти наблюдения не дают никакой информации о внутреннем состоянии газа. Та же самая масса газа в сосуде большего объема будет вообще иметь более низкое давление, но, независимо от размера сосуда, кинетическая энергия газа будет та же самая, если скорость сосуда та же самая. В этом случае скорость и кинетическая энергия газа в целом - внешние координаты, в то время как его давление и объем - внутренние или термодинамические координаты. Значения термодинамических координат определяют термодинамическое состояние системы. Когда все его термодинамические координаты становятся постоянными, система, как говорят, достигает состояния термодинамического равновесия.
Взаимодействия, которые могут произойти между системой и ее окружением или между одной системой и другой определяются природой стенок. Эти взаимодействия могут классифицироваться как механическая работа, как в случае растяжения пружины, или тепловые, когда тело помещается в пламя горелки. Оба типа процесса могут привести к изменениям в термодинамических координатах системы. Мы рассматриваем случай тепловых взаимодействий.
Рассмотрим две системы А и B. Пусть система А содержит некоторое количеством воздуха в емкости, а система В представляет собой медный блок, внутри которого находится катушка проволоки высокого сопротивления, сквозь которую может проходить электрический ток. На рис. 18.9 система А находится в термодинамическом равновесии (ее объем и давление являются установившимся) и изолирована толстой стенкой дерева или полистирола от системы B, которая находится также в равновесии в отсутствии тока. Когда ток пропускается через нагреватель в системе B, таким образом изменяя его состояние (нагревая ее), нет никакого непосредственного эффекта на систему A; только через достаточно продолжительное время возможно заметить изменения давления и объема. Это приводит нас к идеальному понятию, называемому адиабатической перегородкой, которая позволяет изменять состояния двух систем независимо друг от друга. Адиабатический процесс - процесс, который происходит в системе, термически изолированной от других систем и от окружения. Сосуд Дьюара (термос) - хорошая практическая реализация такой адиабатической оболочки.

Рис. 18.9. Системы А и В термически изолированы друг от друга адиабатической стенкой. Изменение состояния одной из систем не влияет на состояние другой.
На рис. 18.10 те же самые две системы были приведены в прямой контакт. В этом случае прохождение электрического тока через катушка в системе B заставляет изменяться давление в системе А, то есть состояние одной системы влияет на состояние другой. Стенка, которая позволяет это делать названа диатермической мембраной. Это - общая граница систем А и B на Рис 10, но во многих практических ситуациях тонкий слой металла играет роль хорошей диатермической мембраны. Две системы, отделенные диатермической мембраной, как говорят, находятся в термическом (тепловом) контакте.
Когда системы А и B находятся в термическом контакте друг с другом, но термически изолированы от окружения их термодинамические координаты становятся установившимися через некоторое время. Они находятся тогда в тепловом равновесии друг с другом. Практически, когда мы говорим, что две системы находятся в тепловом равновесии, мы подразумеваем, что если они были приведены в термический контакт, тогда не будет никаких изменений в их наблюдаемых свойствах.
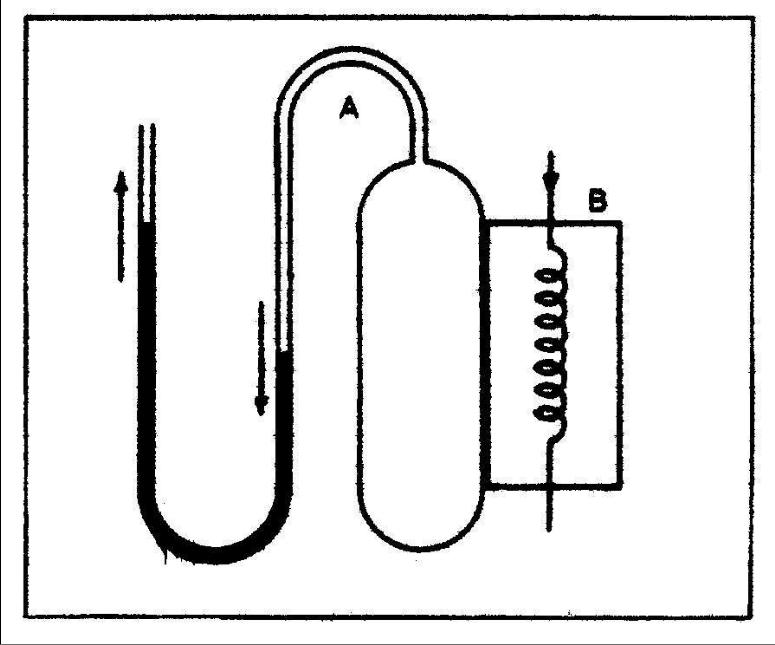
Рис. 18.10. Системы А и В находятся в тепловом контакте друг с другом через диатермическую стенку.
На рис. 18.11a представлены три системы A, B и C, изолированные от окружения адиабатической перегородкой. Системы А и B изолированы друг от друга адиабатической перегородкой, но каждая из них находится в тепловом контакте с системой C через диатермическую мембрану. Каждый из систем А и B отдельно достигнет теплового равновесия с системой C. Когда адиабатическая перегородка между системами А и B заменяется диатермической стенкой (рис. 18.11b), никакие изменения в системах А и B не происходят. Наконец на рис. 18.11c диатермическая мембрана, отделяющая систему C от других двух систем заменена адиабатической перегородкой. Никакие изменения не происходят и в этом случае, потому что системы А и B уже находятся в тепловом контакте и в равновесии. Таким образом, мы обнаружили, что две системы, каждая из которых находится отдельно в тепловом равновесии с третьей системой, находятся и в тепловом равновесии друг с другом. Это и есть нулевой закон термодинамики и это базис понятия температуры и принцип температурных измерений.
Свойство, которое имеет то же самое значение для всех систем в тепловом равновесии, названо температурой; таким образом системы A, B и C имеют одну и ту же температуру, если две системы, имеющие различные температуры приведены в тепловой контакт, их термодинамические координаты изменяются до тех пор, пока системы не достигают теплового равновесия друг с другом, то есть пока они оба не будут иметь одну и ту же температуру.
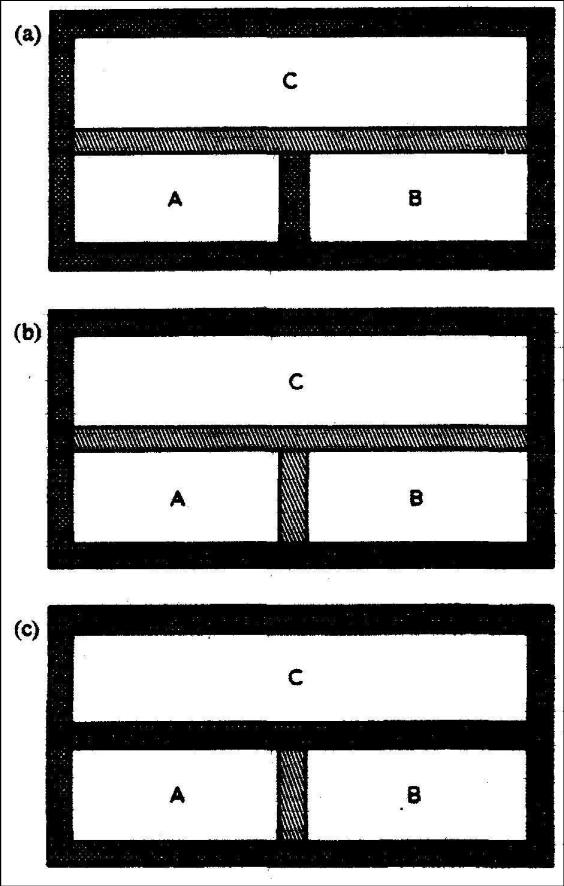
Рис. 18.11. Нулевой закон термодинамики.
Заштрихованые стенки - диатермические.
Температура измеряется термометром, который является просто системой, имеющей термодинамические координаты, которые легко наблюдать. Система А на рис. 18.11 может служить таким примером. Предположим, что мы измеряем давление, когда некоторый ток течет через катушку и достигнуто тепловое равновесие между системами А и B. Допустим теперь, что система А удаляться от B и помещена в тепловой контакте с ванной с жидкостью. Если показания манометра остаются теми же самыми, что и прежде, мы может сказать, что медный блок и ванна имеют одну и ту же температуру, хотя мы еще не имеем возможности дать числовое значение температуры.
