
- •1. Ресурсы поверхностных вод и запасы льдов
- •2. Ресурсы подземных вод.
- •3. Круговорот природных вод.
- •4. Строение молекулы воды. Структура воды.
- •5. Физические свойства воды и её аномалии
- •6. Понятие о системах фазах и компонентах.
- •7. Классификация природных вод.
- •8. Факторы формирования химического состава природных вод
- •I группа: факторы непосредственно воздействующие на воды (породы, почвы, живые организмы, деятельность человека)
- •1)Соли.
- •2) Изверженные и метаморфические породы
- •3) Глинистые породы
- •2. Почвы
- •3. Живые организмы
- •4. Деятельность человека
- •II группа: факторы, определяющие условия, в которых протекает взаимодействие вещества с водой (климат, рельеф, растительность, водный режим, взвешенные вещества, донные отложения)
- •1. Климат
- •2. Рельеф местности
- •3. Водный режим (или гидрологический режим)
- •4. Взвешенные веществ
- •Донные отложения ила
- •9. Процессы формирования химического состава природных вод
- •10. Процессы переводящие вещество в раствор.
- •11. Процессы, выводящие вещество из раствора.
- •12. Обменные процессы вещества.
- •13. Формирование ионного состава природных вод
- •5% Апатит Ca10r2(po4) (r-cl или f)
- •14 . Формрование биогенных веществ природных вод.
- •16. Формирование микроэлементного состава природных вод.
- •17. Формирование газового состава природных вод.
- •18. Влияние загрязненных веществ на химический состав прир. Вод.
- •19. Равновесные системы в природных водах.
- •21. Расчеты карбонатного равновесия для природных вод с минерализацией более 100 мг/дм3 с учетом активности ионов
- •22. Расчет концентраций отдельных форм производных угольной кислоты
- •23. Расчет степени насыщаемости природных вод СаСо3
- •24. Буферность карбонатных систем.
- •25. Сульфидное равновесие
- •26. Окислительно-восстановительные равновесия
- •27. Буферная способность почв
- •28. Кислотность почв
- •29. Миграция химических соединений
- •30 Виды миграции
- •31. Интенсивность миграции
6. Понятие о системах фазах и компонентах.
ДИАГРАММА СОСТОЯНИЯ ВОДЫ.
Системой называют тело, группу тел или веществ, находящихся во взаимодействии и мысленно обособленных от окружающей среды.
Гомоленные системы - однородные системы внутри которых нет поверхностей раздела. (*водные растворы твердых, жидких и газообразных веществ).
Гетерогенные системы – неоднор. сист., состоящие из неск. фаз имеющие поверхность раздела.
Фаза – совокупность гомогенных частей, гетерогенной системы, одинаковых по составу, по хим. и физическим свойствам и ограниченных от других частей системы поверхностью раздела.
Компонент - каждое содержащееся в системе химически однородное вещество, которое после выделения из системы может существовать в изолированном виде.
Устойчивость гетерогенных систем определяется фазовыми и химическими равновесиями. При фазовых равновесиях переход компонентов из одной фазы из одной фазы в другую не сопровождается химическим взаимодействием. Число термодинамических степеней свободы системы при равновесии определяется числом условий которые можно изменять в определенных пределах не нарушая при этом числа и видов фаз системы. Для физических равновесий такими условиями являются концентрация, температура и давление. Равновесие в таких системах подчиняется правилу фаз Гиббса.
С=К+2-Ф
С не может быть <0 (!!!) |
С – число степеней свободы; К – количество компонентов; Ф- количество фаз. |
При этом допускается, что на систему оказывает влияние только температура и давление число термодинамических степеней свободы определяет вариантность системы. Если С = 0, то система инвариантна. С=1, то 1 степень свободы, 1 вариантная и т.д.
Для однокомпонентной системы при независимых переменных температуры и давлении число степеней свободы будет определяться как С=3-Ф. Наибольшее число контактирующих фаз в однокомпонентной системе равно 3 (вода: ж, пар, лед).
Диаграмма состояния воды.
Н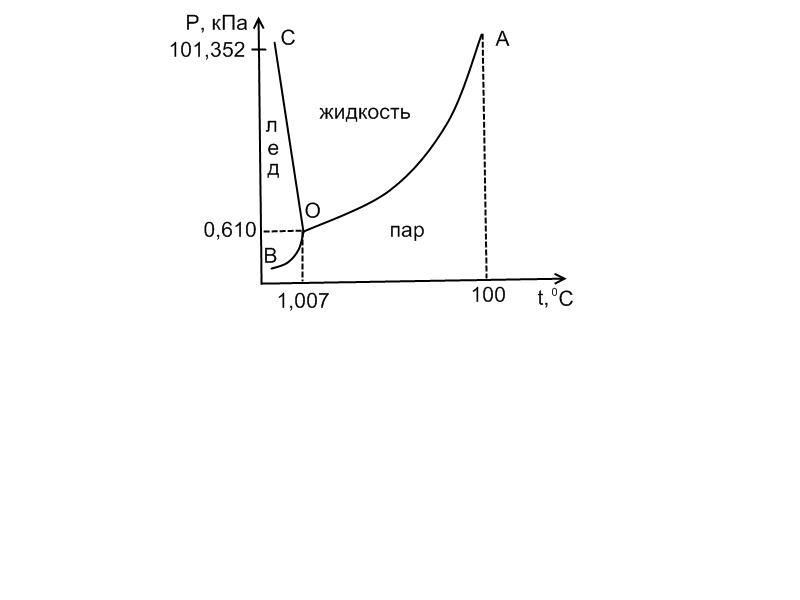 а
этой диаграмме кривая
а
этой диаграмме кривая
ОА определяет устойчивость системы ж-пар;
ОВ - устойчивость системы лед – пар;
ОС - выражает изменение температуры плавления льда в зависимости от внешнего давления.
Очень незначительное влияние связано с тем, что при увеличении давления разрушается кристаллическая решетка льда, и температура плавления несколько снижается.
Кривыми ОА, ОС и ОВ диаграмма разделяется на 3 части, которые характеризуют присутствие лишь одной фазы (жидкость, пар или лед).
Все линии пересекаются в точке О, которая называется тройной. Этой точке отвечает температура 0,0070С и давление 613 Па или 4,6 мм.рт.ст. При таких условиях, находятся в равновесии все три фазы (жидкость, пар и лед), в этой точке система инвариантна.
7. Классификация природных вод.
Классификация (I) по минерализации, (II) по химическому составу.
(I) По минерализации:
Минерализация воды - суммарное соединение в воде всех найденных при химическом анализе минеральных веществ.
Границу пресных вод характеризует значение минерализации 1000мг\л.
Классификация Вернандского В.И.: 4 группы природных вод:
Пресные воды – содержащие солей до 1г в литре
Солоноватые воды – 1-10 г\л
Соленые воды – 10- 50 г\л
Рассолы – > 50г\л
(II) По химическому составу:
Чаще всего применяют классификацию сочетающую принцип деления химического состава по преобладающим ионами по количественному соотношению между ионами наибольшим относительно содержанием в % в перерасчете на эквиваленты.
По преобладающему аниону природные воды делятся на 3 класса:
1. Гидрокарбанатные и карбонатные воды. Большая часть маломинерализованных вод рек, озер , водохранилищ и некоторые подземные воды.
2. Сульфатные воды. Они являются промежуточными. Генетически связаны с различными осадочными породами.
3. Хлоридные воды. Прежде всего высоко минерализованные воды океанов, морей, соленых озер, а также подземные воды закрытых структур.
По преобладающему катиону каждый класс делится на 3 группы: группа Сa, Мg и Na.
Каждая группа в свою очередь делится на 4 вида вод.
Эти типы определяются соотношением между содержанием иона в пересчете на эквиваленты.
(1 тип ) HCO3- > Ca2+ + Mg2+
Этот первый тип формируется при взаимодействии природных вод с так называемыми и изверженными породами, которые содержат большие количества ионов Na+ и K+. В отдельных случаях воды 1-ого типа могут образовываться в результате обмена ионов Ca+ ион Na+, которые содержатся либо в почвах, либо в породах, например, в щелочных типах.
(2 тип) HCO3- < Ca2+ + Mg2+ < HCO3- + SO42-
Этот тип природных вод формируется при взаимодействии с различными осадочными породами и продуктами выветриванием коренных пород. Сюда относятся большинство рек и озер, подземные воды талой и умеренной минерализации .
(3 тип.) Ca2+ + Mg2+ > HCO3- + SO42- или CI- > Na+
Третий тип образуется в результате испарения воды и катионного обмена. Обычно ион Na+ из раствора обменивается на ноль Ca2+ и Mg2+ почв и пород. К этому 3 типу относят воды океанов, морей, многих соленых озер и большинство сильноминерализованных подземных вод.
(4 тип.) HCO3- = 0
Характеризуется отсутствием гидрокарбанатов .Формируется выветривании и разработке сульфидных месторождений , а также богатых угольным залежью, при вулканической деятельности относят иода кратерные озера , горячие источники , формируются при активных сульфат редуцирующих процессах .Воды Нефтяных месторождений и вулканов. Воды северных влажных областей – это воды Тундры и воды Торфяника. Возможность существующих природных вод другого класса – нитратный, боратный не исключена, но маловероятно. Более реально преобладание в водах кремневой кислоты. Но эта кислота почти полностью не диссоциированна и не уравновешивает катионы. Не выделяют в отдельный класс природные воды с преобладанием органического вещества, так как организм обладает сложным составом.
