
- •1. Ресурсы поверхностных вод и запасы льдов
- •2. Ресурсы подземных вод.
- •3. Круговорот природных вод.
- •4. Строение молекулы воды. Структура воды.
- •5. Физические свойства воды и её аномалии
- •6. Понятие о системах фазах и компонентах.
- •7. Классификация природных вод.
- •8. Факторы формирования химического состава природных вод
- •I группа: факторы непосредственно воздействующие на воды (породы, почвы, живые организмы, деятельность человека)
- •1)Соли.
- •2) Изверженные и метаморфические породы
- •3) Глинистые породы
- •2. Почвы
- •3. Живые организмы
- •4. Деятельность человека
- •II группа: факторы, определяющие условия, в которых протекает взаимодействие вещества с водой (климат, рельеф, растительность, водный режим, взвешенные вещества, донные отложения)
- •1. Климат
- •2. Рельеф местности
- •3. Водный режим (или гидрологический режим)
- •4. Взвешенные веществ
- •Донные отложения ила
- •9. Процессы формирования химического состава природных вод
- •10. Процессы переводящие вещество в раствор.
- •11. Процессы, выводящие вещество из раствора.
- •12. Обменные процессы вещества.
- •13. Формирование ионного состава природных вод
- •5% Апатит Ca10r2(po4) (r-cl или f)
- •14 . Формрование биогенных веществ природных вод.
- •16. Формирование микроэлементного состава природных вод.
- •17. Формирование газового состава природных вод.
- •18. Влияние загрязненных веществ на химический состав прир. Вод.
- •19. Равновесные системы в природных водах.
- •21. Расчеты карбонатного равновесия для природных вод с минерализацией более 100 мг/дм3 с учетом активности ионов
- •22. Расчет концентраций отдельных форм производных угольной кислоты
- •23. Расчет степени насыщаемости природных вод СаСо3
- •24. Буферность карбонатных систем.
- •25. Сульфидное равновесие
- •26. Окислительно-восстановительные равновесия
- •27. Буферная способность почв
- •28. Кислотность почв
- •29. Миграция химических соединений
- •30 Виды миграции
- •31. Интенсивность миграции
19. Равновесные системы в природных водах.
Эти системы можно разделить на 3 группы:
Равновесие между формами H2CO3, борной, фосфорной, Н2SO4, кремниевой и др. слаб. к-т
Равновесие в системе вода - малорастворимое вещество
Окислительно-восстановительные равновесия
Карбонатная система представляет собой сложное равновесие, которое вкл. в себя абсорбционно-гидратационное равновесие р-ра с газ.фазой; многоступ.диссоциацию в р-ре и гетерогенное равновесие р-ра с тв.фазой. Эту систему для поверхн. водпредставим в виде схемы:
С О2
атм
О2
атм
 Давление
Давление
С

 О2
газ
Температура
О2
газ
Температура
Р
 азложение
органич. в-ва СО2
раствор+ Н2О
Н2СО3
азложение
органич. в-ва СО2
раствор+ Н2О
Н2СО3
Д ыхание
животных
ОН-
+Н+
+НСО3-
ыхание
животных
ОН-
+Н+
+НСО3-
О2 фотосинтез растений Н+ +СО32-
СО32- + Са2+
СаСО3 раствор
СаСО3 тв
Состоянием карбонатного равновесия определяется значение рН большинства природных вод, определяются буферные свойства прир вод. Эти св-ва обеспечивают благопр. условия для сущ-я водных организмов, способность воды к растворению или осаждению СаСО3. Компоненты данной системы могут влиять на состояние др. равновесий, вкл-их ионы кальция и карбонат-ионы: сульфатно-кальциевое равновесие, фосфатно-кальциевое, железо-карбонатное. Через рН можно влиять на окисл-восстановит равновесие. Гл. задачей карбонатной системы является определение конц-ии форм производных Н2СО3, равновесного или агрессивного СО2, степенью насыщенности воды карбонатом кальция. В основе расчета карбонатной системы различных прир вод лежат одни и те же равновесия. В зависимости от ионного состава прир вод м.б. след. варианты определения конц-ии форм Н2СО3: ∑СО2 = [СО2] + [Н2СО3] + [НСО3-] + [СО32-] (1)
К 1
= [Н+][
НСО3-]
/ [ Н2СО3]*
(2) минерализация
1
= [Н+][
НСО3-]
/ [ Н2СО3]*
(2) минерализация
К2 = [Н+][СО32-] / [ НСО3-] (3) менее 100мг/дм3
К 1
= аН+[
НСО3-]
γНСО3-
/
[
Н2СО3]**
(4) минерализация
1
= аН+[
НСО3-]
γНСО3-
/
[
Н2СО3]**
(4) минерализация
К2 = аН+ [СО32-] γСО32- / [НСО3-] γНСО3- (5) более 100мг/дм3
При невозможности аналитического опред-я отдельных составляющих производят расчет форм производных Н2СО3 по известной сумме конц-ии СО2, значение рН по уравнениям 1-3 или 1, 4, 5.
*под концентрацией Н2СО3 понимается общая концентрация [СО2 + Н2СО3], допускается, что растворенный СО2 находится в виде Н2СО3.
**для недиссоциированной Н2СО3 коэффициент активности принимается = 1.
Если позволяет точность методов определения, часть составляющих определяют аналитически, а конц-ию остальных компонентов устанавливают расчетом с использованием ур-ий 2-5 или 6-7:
-
ССО2 = РСО2 * SСО2 (6)
Alk = НСО3- + 2СО32- (7)
ССО2 - концентрация возбужденного СО2,
РСО2 – парциальное давление СО2,
SСО2 – раств-ть СО2 при данной температуре и атм.давл.105Па
Alk – карбонатная щелочность
При анализе получают общую щелочность:
Alkобщ = НСО3- + 2СО2- + НСО3- +Н2ВО3- + НS- +Н2РО4- + ОН- + Н+
Концентрация остальных компонентов незначительна, поэтому в большинстве случаев можно принять значение общей щелочности за карбонатную щелочность. Концентрацию равновесного СО2 и степень насыщенности воды карбонатом кальция определяют расчетом. Концентрацию агрессивного СО2 определяют либо расчетом, либо анализом с применением порошка мрамора, либо искусственно приготовленного СаСО3. Характерные показатели СаСО3: концентрация агрессивного СО2 и степень насыщенности воды карбонатом кальция.
20. РАСЧЕТЫ КАРБОНАТНОГО РАВНОВЕСИЯ ДЛЯ ПРИРОДНЫХ ВОД С МИНЕРАЛИЗАЦИЕЙ < 100 мг/дм3 БЕЗ УЧЕТА АКТИВНОСТИ ИОНОВ
До 100 мг/дм3 расчёты карбонатной системы можно производить без учёта индивидуальных ионов, зная константы соответствующих равновесий. Совместное решение уравнений 1, 2, 3 даёт выражение для отдельных форм производных Н2СО3 .
∑СО2 = [СО2] + [Н2СО3] + [НСО3-] + [СО32-] (1)
К1 = [Н+][ НСО3-] / [ Н2СО3]* (2) минерализация
К2 = [Н+][СО32-] / [ НСО3-] (3) менее 100мг/дм3
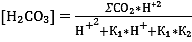 (8)
(8)
 (9)
(9)

По уравнениям 8,9,10 можно вычислить соотношение молярных концентраций отдельных форм производных Н2СО3 при различных значениях рН, выраженные в % их общего содержания.
Таблица
форма |
рН |
||||||
|
4 |
5 |
6 |
7 |
8 |
9 |
10 |
[СО3+Н2СО3] |
99,7 |
96,2 |
71,5 |
20,0 |
2,4 |
0,4 |
- |
[НСО3¯] |
0,3 |
3,8 |
28,5 |
80,0 |
97,2 |
95,7 |
70,4 |
[СО3²¯] |
- |
- |
- |
- |
0,4 |
4,1 |
29,6 |
С увеличением рН увеличивается концентрация ионных форм Н2СО3.
Но в действительности в природных условиях в большинстве случаев не концентрация форм производных Н2СО3зависит от рН, а именно соотношение форм карбонатного равновесия определяет значения рН.
Основными же факторами, от которых зависит равновесие, является концентрация Н2СО3 и ионов Са²⁺. Концентрация Н2СО3 определяет конц-ю НСО₃¯, а конц-я Са²⁺ ограничивает растворимость СаСО₃ и влияет на концентрацию иона СО₃².¯
