
- •1. Ресурсы поверхностных вод и запасы льдов
- •2. Ресурсы подземных вод.
- •3. Круговорот природных вод.
- •4. Строение молекулы воды. Структура воды.
- •5. Физические свойства воды и её аномалии
- •6. Понятие о системах фазах и компонентах.
- •7. Классификация природных вод.
- •8. Факторы формирования химического состава природных вод
- •I группа: факторы непосредственно воздействующие на воды (породы, почвы, живые организмы, деятельность человека)
- •1)Соли.
- •2) Изверженные и метаморфические породы
- •3) Глинистые породы
- •2. Почвы
- •3. Живые организмы
- •4. Деятельность человека
- •II группа: факторы, определяющие условия, в которых протекает взаимодействие вещества с водой (климат, рельеф, растительность, водный режим, взвешенные вещества, донные отложения)
- •1. Климат
- •2. Рельеф местности
- •3. Водный режим (или гидрологический режим)
- •4. Взвешенные веществ
- •Донные отложения ила
- •9. Процессы формирования химического состава природных вод
- •10. Процессы переводящие вещество в раствор.
- •11. Процессы, выводящие вещество из раствора.
- •12. Обменные процессы вещества.
- •13. Формирование ионного состава природных вод
- •5% Апатит Ca10r2(po4) (r-cl или f)
- •14 . Формрование биогенных веществ природных вод.
- •16. Формирование микроэлементного состава природных вод.
- •17. Формирование газового состава природных вод.
- •18. Влияние загрязненных веществ на химический состав прир. Вод.
- •19. Равновесные системы в природных водах.
- •21. Расчеты карбонатного равновесия для природных вод с минерализацией более 100 мг/дм3 с учетом активности ионов
- •22. Расчет концентраций отдельных форм производных угольной кислоты
- •23. Расчет степени насыщаемости природных вод СаСо3
- •24. Буферность карбонатных систем.
- •25. Сульфидное равновесие
- •26. Окислительно-восстановительные равновесия
- •27. Буферная способность почв
- •28. Кислотность почв
- •29. Миграция химических соединений
- •30 Виды миграции
- •31. Интенсивность миграции
4. Строение молекулы воды. Структура воды.
Основу природных вод составляет химическое соединение, имеющее формулу Н2О. молекула воды состоит из двух атомов Н и 1 атома О. ядра атомов в молекуле воды расположены по углам равнобедренного треугольника. В вершине находится ядро атома О.
а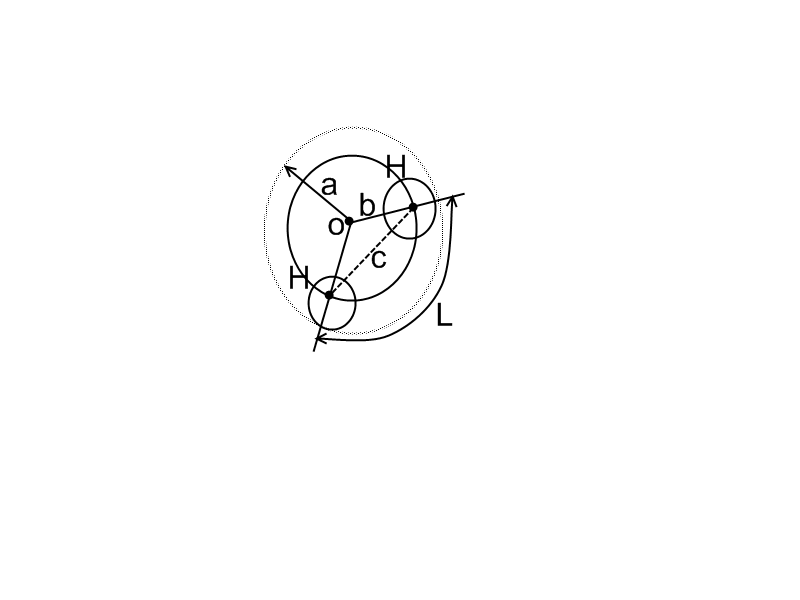 – радиус молекулы
– радиус молекулы
b- межъядерное расстояние
с – расстояние между двумя ядрами Н
L- угол, образовавшийся радиусами ОН
b=0,0958 нм – для газа L=104027,
b=0,09572 нм – в жидкой фазе L=104031,
b=0,099 нм – в твердой фазе
Колебательное, вращательное и электронное возбуждение молекул Н2О вызывает изменения размеров и формы молекулы. Причем энергетически выгодной является одновременная деформация угла и длины связи ОН.
Электронное облако молекулы Н2О имеет вид 4 лепестков, направленных к вершинам неправильного тетраэдра. В 2х вершинах одной грани находятся электронные пары, осуществляющие связь ОН, а в 2х вершинах противоположной грани находятся неподеленные электронные пары атома О.
Электронное облако в Н2О смещается к атому О, поскольку он имеет большую электроотрицательность. Вследствие этого вблизи ядер атома Н образуется избыток положительного заряда, поэтому молекула Н2О является полярной. Полярные молекулы характеризуются электрическим моментом диполя. Электрический момент диполя влияет на свойства Н2О. он представляет собой произведение одного из зарядов на расстояние между центрами положительного и отрицательного зарядов.
Р=6*10-28 Кл*м
Благодаря большому значению Р между молекулами Н2О проявляется сильное взаимодействие, образуются водородные связи между атомами О одной молекулы и атомами Н другой молекулы. Каждая молекула Н2О может образовывать 4 водородные связи. 2 связи возникаю при взаимодействии неподеленных электронных пар атома О с атомами Н соседних молекул Н2О и 2 связи дают атомы Н взаимодействующие с атомами О двух других молекул Н2О.Длина водородной связи 0,14-0,2 нм, т.е.она сопоставима с размерами молекулы Н2О. и водородная связь имеет достаточно большую энергию 17-33 кДЖ/моль.
5. Физические свойства воды и её аномалии
Существование водородных связей объясняет ряд аномалий в свойствах Н2О. Под аномалиями принято понимать свойства Н2О, которые отличают воду от ее химических аналогов (Н2S, H2Se).
Температурные аномалии жидкой воды:
30– 400С наблюдаются изменения в свойствах воды. При 350С - имеет наименьшую плотность.
При 0– 350С наблюдается резкое падение электронной поляризуемости воды под действием внешнего поля. С этой аномалией воды связывают ее биологическую активность с организмами, имеющими температурный оптимум около 370С.
55 – 600С. При 550С наблюдается минимум изменения электронной поляризуемости молекул Н2О под действием адиабатического сжатия, отмечается минимум диэлектрической проницаемости в зависимости от давления, увеличивается звукопередача. Вода имеет самую высокую теплоемкость среди твердых и жидких веществ, за исключением жидкого аммиака. Высокая теплоемкость воды обуславливает большой перенос тепла водными океаническими течениями; способствует терморегуляции живых организмов.
Аномальная плотность воды: pлeд < pж.вода, max p при t = 40С.
Так же при замерзании воды происходит увеличение объем примерно на 10%. При плавлении льда нарушается его регулярная структура, и часть комплексов разрушается. При этом в Н2О наряду с участками, имеющими структуру аналогичную кристаллической решетке льда, появляются одиночные молекулы, они заполняют полости, сохранившиеся в участках с льдоподобной структурой. С повышением температуры проявляется действие двух факторов: теплового расширения и нарушения регулярной структуры льда. Тепловое расширение сопровождается незначительным увеличение объема и связано с нарушением упорядоченности расположения молекул. При 40С оба этих фактора одинаковы по абсолютной величине, но противоположны по направленности действия. При дальнейшем увеличении температуры снижается действие второго фактора, больше проявляется действие теплового расширения, плотность воды уменьшается.
Лед легче жидкой воды. В результате этого замерзание происходит с поверхности водоема, сохраняется жизнь в водоеме. Этому также способствует малая теплопроводность льда и снега.
Также у воды наиболее высокая теплота испарения. Это свойство очень важное и прежде всего влияет на перенос тепла и воды в атмосфере.
Вода имеет наиболее высокое поверхностное натяжение. По величине поверхностного натяжения вода уступает только ртути. Это свойство играет важную роль при протекании биохимических процессов, и оно очень важно для физиологии клетки.
Вода – единственно на Земле вещество, которое одновременно может находиться в 3х агрегатных состояниях. В этом состоит еще одна аномалия воды.
В жидком виде вода прозрачна, мало рассеивает свет, поэтому бесцветна, но очень сильно поглощает излучение УФ и ИК области спектра. Это свойство воды играет важную роль для протекания физических и биохимических процессов.
Способность многих веществ растворяться в воде и диссоциировать на ионы определяется высокой диэлектрической проницаемостью воды. Эта особенность воды определяет самую большую растворяющую способность в отношении веществ с полярной и ионной структурой и тем самым связывает физические и биологические явления.
Теплопроводность воды наиболее высокая из всех жидкостей. Это явление играет основную роль в так называемых процессах малого масштаба, т.е.в процессах, которые происходят в живых клетках.
Аномально изменяется вязкость воды при повышении давления. Вязкость воды в интервале температур 0 – 300С с увеличение давления уменьшается, проходит через минимум, а затем возрастает. Это свойство определяет гидродинамику водных объектов и осаждение взвешенных веществ.
Основные константы воды.
Молекулярная масса |
18,0154 |
Плотность жидкой воды (250С) кг/м3 |
997,975 |
Плотность льда (00С) кг/м3 |
916,8 |
Теплота образования при 250С кДж/моль Пар Жидкая вода |
241,9845 286,0313 |
Теплота плавления кДж/моль |
6,012 |
Теплота испарения кДж/моль |
44,041 |
Удельная теплоемкость кДж/кг*К Лед Жидкость Пар |
2,039 4,187 2,039 |
Теплопроводность Вт/м*К Лед (00С) Жидкость (200С) Жидкость (450С) Пар (1000С) |
2,34 0,598 0,645 0,0231 |
Криоскопичекая константа |
1,850 |
Вязкость (250С) мПа*с |
1,002 |
Температура максимальной плотности (0С) |
3,98 |
Диэлектрическая постоянная жидкой воды (170С) |
81 |
Диэлектрическая постоянная льда (-10С) |
79 |
Поверхностное натяжение Н/м |
72,5*10-3 |
Приведенные в таблице свойства относятся к воде, молекула которой состоит из 2х атомов Н и одного атома О с атомной массой 16, но в природе существуют другие устойчивые изотопы Н, а именно дейтерий и тритий, и изотопы О с атомной массой 17 и 18.
ТЯЖЕЛАЯ ВОДА.
Наибольшее практическое значение имеет тяжелая вода с молекулярной массой 20. Такая молекула состоит из 2х атомов дейтерия и 1 атома О с атомной массой 16.
Свойства тяжелой воды: tкип=101,40С, tзам=+3,80С, ρ25С=1004,2 кг/м3, max ρ=1055,9 к/м3(t=11,20C). Молекулы тяжелой воды образуют межмолекулярные дейтериевые связи, они прочнее водородных, поэтому структура тяжелой воды более стабильна.
Получение тяжелой воды: При электролизе обычной воды тяжелая вода накапливается в осадке. Свойства тяжелой воды: Растворимость солей в тяжелой воде на 10-20% меньше чем в обычной. Тяжелая вода угнетает жизнедеятельность растений и животных. В природных водах содержание тяжелой воды составляет примерно 0,02%. Большая концентрация тяжелой воды может быть, если водные объекты находятся в условиях, способствующих испарению, поэтому в морской воде концентрация тяжелой воды выше, чем в пресной. Повышенное содержание тяжелой воды наблюдается также в живых организмах и минералах. Тяжелая вода может взаимодействовать с обычной, и в этом случае образуется соединение HDO. Вязкость тяжелой воды на 20% выше чем у обычной. Это свойство используется для определения концентрации тяжелой воды в смеси с обычной.
