
Определение порядка реакции по периоду полупревращения
Для определения порядка реакции вторым способом необходимо из графика(см. рис. 1) определить несколько периодов полупревращения, например, для С1=1,00 моль/дм³; С2= 0,90 моль/дм³; С3= 0,80 моль/дм³; С4= 0,70 моль/дм³. На рис. 1 показано как определить τ1/2 для С4= 0,70 моль/дм³. Период полупревращения τ1/2 определяют из выражения
τ1/2 = τ2 – τ1 = 146 – 61 = 85 с.
Определив τ1/2 для всех концентраций, сведем данные в табл. 5.
Таблица 5
Период полупревращения τ1/2(i) при различных исходных концентрациях Ci0
Ci0, моль/дм³ |
1,00 |
0,90 |
0,80 |
0,70 |
τ1/2 ,с |
109 |
102 |
95 |
85 |
-lg Ci0 |
0 |
0,046 |
0,097 |
0,155 |
lg τ1/2(i) |
2,03 |
2 |
1,98 |
1,93 |
Период полупревращения связан с порядком реакции уравнением
τ1/2
=
 ·
C¹-ⁿ.
(5)
·
C¹-ⁿ.
(5)
Обозначив отношение = В и прологарифмировав (5), получим
lgτ1/2 = lgB + (1-n) lgC0. (6)
Выражение (6) является уравнением прямой в координатах lgτ1/2 - lgC0,
Построим эту прямую на рис. 3 и определим порядок из уравнения
n2 = 1-tgα. (7)
Определяем из рис. 3 тангенс угла наклона прямой
tgα
=
 =
0,625.
=
0,625.

Рис. 3. Зависимость десятичного логарифма периода полупревращения τ1/2 от исходной концентрации С0
Из уравнения (7) определим порядок n2 = 1-0,625 = 0,375.
Поскольку порядки, найденные разными способами, различны, то истинный порядок определяем как среднее между двумя значениями:
n
=
 =
=
 =
0,3975.
=
0,3975.
Подставив в уравнение (1) найденный порядок реакции, определим вид кинетического уравнения:
kτ
=
( -
- )
)
 kτ
= -
kτ
= -
 (
(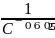 -
-
 ).
).
По уравнению (8), зная исходные концентрации Ci0 и текущие - Ci в момент τi , можно рассчитать константы скорости при требуемых температурах Т1 -Т4,
Значения исходных и текущих концентраций через 15 с от начала реакции возьмем из табл. 3.
К1=
 (
(
 -1)
=
5,7·10‾³(
дм³/моль)-0,6025·с‾¹(Т1=485К).
-1)
=
5,7·10‾³(
дм³/моль)-0,6025·с‾¹(Т1=485К).
К2=(1/15·(-0,6025))((1/0,96 )-1)=
2,68·10‾³( дм³/моль)-0,6025·с‾¹(Т1=472К).
)-1)=
2,68·10‾³( дм³/моль)-0,6025·с‾¹(Т1=472К).
К3=(1/15·(-0,6025))((1/0,97 )-1)=2,01·10‾³( дм³/моль)-0,6025·с‾¹(Т1=465К).
К4=(1/15·(-0,6025))((1/0,98 )-1)=1,33·10‾³( дм³/моль)-0,6025·с‾¹(Т1=457К).
Определение энергии активации и предэкспоненциального множителя
Зависимость константы скорости k от температуры Т описывается основным уравнением химической кинетики (уравнение Аррениуса)
k = k0 · e-E/RT , (9)
где k0 – предэкспоненциальный множитель;
e – основание натурального логарифма;
Е – энергия активации;
R – универсальная газовая пастоянная.
В малом интервале температур( до 200 К) величины k0 и Е изменяются незначительно и их можно считать постоянными. Это допущение дает возможность определить их значения графически. После логарифмирования уравнения (9)
lnk
= lnk0
-
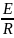 ·
·
 .
(10)
.
(10)
Видно, что в координатах lnk - график этой функции представляет собой прямую, тангенс угла наклона которой есть отношение E/R, т.е.
tgα = E/R. (11)
Для построения графика сведем ранее определенные данные в табл. 6.
Таблица 6
Значение константы скорости ki при различных температурах Тi
Ti, K |
485 |
472 |
465 |
457 |
ki, ‾³( дм³/моль)-0,6025·с‾¹ |
5,70 |
2,68 |
2,01 |
1,33 |
|
2,06 |
2,11 |
2,15 |
2,18 |
-lnki |
5,17 |
5,92 |
6,21 |
6,62 |
По данным табл.6 построена зависимость, представленная на рис.4.

Рис. 4. Зависимость логарифма константы скорости от обратной температуры
Из рис. 4 определяем тангенс наклона:
tgα
=
 = -13235,
= -13235,
и затем из уравнения (11)энергию активации
Е = 13235 · 8,31 = 109983 Дж/моль.
Значение предэкспоненциального множителя найдем из уравнения (10), подставив в него любую пару значений lnk и 1/Т, взятых из рис. 4.
Например, при 1/Т = 2,15·10‾³; lnk = -6,21.
Тогда
lnk0=
lnk
+
·
1/T
= -6,21 +
 2,15·10‾³
= 22,245.
2,15·10‾³
= 22,245.
Откуда k0=e22,245 = 4,58·109.
Итак, все постоянные в уравнениях (9) и (10) известны. Находим k5 при Т5 = 430К.
lnk5
=
22,245 -
· =
-8,533.
=
-8,533.
k5 = e-8,533= 0,2·10‾³‾³( дм³/моль)-0,6025·с‾¹
Используя выражение (8) рассчитаем время, за которое 40% исходных веществ превратятся в продукты реакции, т.е. их концентрация изменится от значения С0 = 1,0 моль/дм³ до значения С = 0,60С0 моль/ дм³ при температуре 430 К.
τ
=
 (
(
 -
1)
=
2196 с.
-
1)
=
2196 с.
Таким образом, при температуре 430 К, при исходных концентрациях реагирующих веществ С0(А)=С0(В)=С0=1 моль/дм³ 40% исходных веществ прореагирует за 2196 с.
Магнитогорск
2011

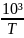 ,
K‾¹
,
K‾¹