
- •Глава 2. Элементы термодинамики
- •2.1. Термодинамический метод
- •2.2. Внутренняя энергия
- •2.3. Работа и количество тепла. Первый закон термодинамики
- •2.4. Работа при равновесном и неравновесном изменении объема системы
- •2.5. Теплоемкость
- •2.6. Теплоемкость молекулярного водорода
- •2.7. Основные термодинамические процессы
- •2.7.1. Изохорный процесс
- •2.7.2. Изобарный процесс
- •2.7.3. Изотермический процесс
- •2.7.4. Адиабатный процесс.
- •2.7.5. Политропные процессы.
- •2.8. Обратимые и необратимые процессы.
- •2.9. Круговые термодинамические процессы или циклы. Тепловые и холодильные машины
- •2.10. Второе начало термодинамики в формулировках Кельвина и Клаузиуса
- •2.11. Цикл Карно
- •2.12. Теоремы Карно
- •2.13. Равенство Клаузиуса. Энтропия
- •2.14. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа
- •2.15. Неравенство Клаузиуса. Общая формулировка второго закона термодинамики
- •2.16. Свободная энергия
- •2.17. Статистическое толкование энтропии
- •2.18. Формула Больцмана
2.5. Теплоемкость
Для вычисления количества теплоты, получаемой или отдаваемой системой при переходе из одного состояния в другое, используется понятие теплоемкости. Это одна из важнейших характеристик вещества. Различают молярную и удельную теплоемкости.
Молярной теплоемкостью называют количество тепла, которое необходимо сообщить одному молю, вещества, чтобы повысить его температуру на 1К:
![]() (2.5.1)
(2.5.1)
Удельной теплоемкостью называют количество тепла, которое нужно передать 1 кг вещества, чтобы повысить его температуру на 1К:
![]() (2.5.2)
(2.5.2)
В последних формулах
– элементарное количество тепла,
переданное веществу,
![]() – изменение его температуры, вызванное
этим теплом,
– изменение его температуры, вызванное
этим теплом,
![]() и
и
![]() – число молей и масса вещества
соответственно.
– число молей и масса вещества
соответственно.
Из формул (2.5.1–2.5.2) нетрудно получить связь между молярной и удельной теплоемкостями:
![]() (2.5.3)
(2.5.3)
где
![]() – молярная масса. В
дальнейшем, в основном, будем использовать
молярную теплоемкость, которую будем
называть просто теплоемкостью.
– молярная масса. В
дальнейшем, в основном, будем использовать
молярную теплоемкость, которую будем
называть просто теплоемкостью.
Элементарное количество теплоты находится из выражения (2.5.1)
![]() (2.5.4)
(2.5.4)
Количество теплоты, получаемое системой при нагревании от температуры до температуры ,
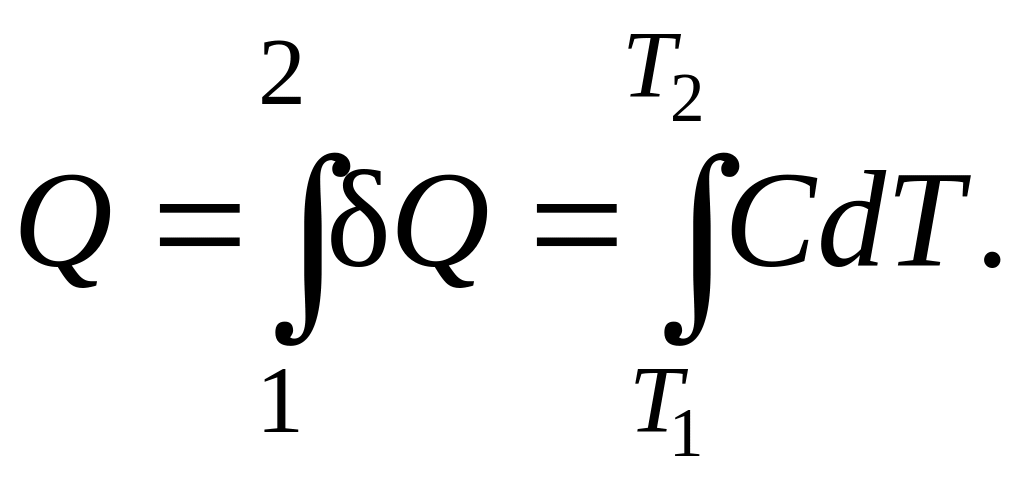 (2.5.5)
(2.5.5)
Из опыта известно, что
теплоемкость в общем случае зависит от
температуры. Поэтому часто при вычислении
количества тепла используют понятие
средней теплоемкости
![]() .
При этом количество тепла
.
При этом количество тепла
![]() (2.5.6)
(2.5.6)
где величину находят, используя теорему о среднем из математического анализа:
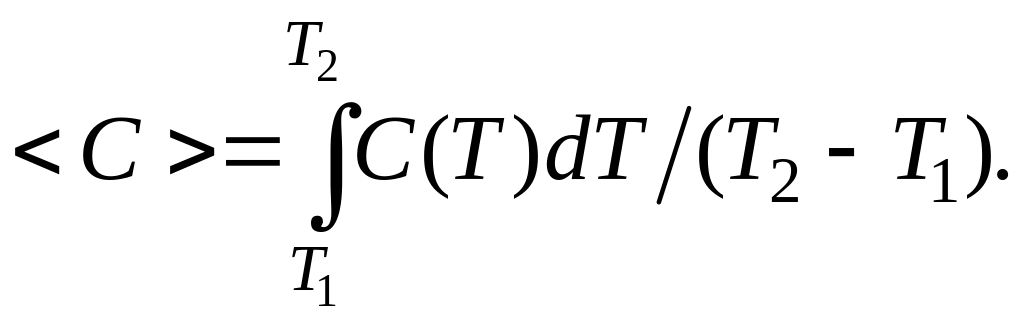 (2.5.7)
(2.5.7)
Если же теплоемкость постоянна в
интервале температур
![]() ,
то из выражения (2.5.5)
,
то из выражения (2.5.5)
![]() (2.5.8)
(2.5.8)
Теплоемкость, как собственное
физическое свойство вещества, зависит
от его природы (химического состава).
Для заданного же вещества теплоемкость
существенным образом зависит от
термодинамического процесса, в результате
которого происходит передача тепла
веществу и переход его из состояния с
одной температурой в состояние с другой
температурой, т. е. теплоемкость есть
функция процесса. Например, при
изотермическом процессе система
получает тепло
![]() а температура все время сохраняется
постоянной, т. е.
а температура все время сохраняется
постоянной, т. е.
![]() ,
следовательно, на основании выражения
(2.5.1) имеем бесконечное значение
теплоемкости для изотермического
процесса
,
следовательно, на основании выражения
(2.5.1) имеем бесконечное значение
теплоемкости для изотермического
процесса
![]() .
При адиабатическом процессе система
не получает и не отдает тепла
хотя
его температура изменяется
.
При адиабатическом процессе система
не получает и не отдает тепла
хотя
его температура изменяется
![]() ,
поэтому теплоемкость любых веществ при
адиабатическом процессе равна нулю
,
поэтому теплоемкость любых веществ при
адиабатическом процессе равна нулю
![]() .
.
Зависимость теплоемкости
от процесса объясняется тем, что
количество тепла
,
входящее в определение теплоемкости,
не является функцией состояния, а
зависит от пути перехода (процесса)
системы из одного состояния в другое.
Таким образом, у всякого вещества имеется
бесконечное множество теплоемкостей,
т. е. столько, сколько имеется путей
перехода из одного состояния в другое.
Чтобы устранить эту неоднозначность,
сравнение теплоемкостей веществ
производят при каком-нибудь заданном
процессе. Обычно различают теплоемкости
при постоянном объеме
![]() и теплоемкость при постоянном давлении
и теплоемкость при постоянном давлении
![]() ,
если в процессе нагревания поддерживаются
постоянными соответ-ственно объем
вещества или давление. Причем для любых
веществ
,
если в процессе нагревания поддерживаются
постоянными соответ-ственно объем
вещества или давление. Причем для любых
веществ
![]() .
В самом деле, при их изохорическом
нагревании работа си-стемой не совершается.
Поэтому все подводимое тепло, согласно
первому закону термодинамики, идет на
увеличение его внутренней энергии, т.
е. на повышение его температуры. Если
же давление системы при нагревании
остается постоянным, то она должна
расширяться (иначе давление будет
расти), совершая внешнюю работу. В этом
случае не все тепло, подводимое к системе,
идет на изменение внутренней энергии,
а часть этого тепла затрачивается на
совершение работы. Следовательно, при
постоянном давлении требуется большее
количество теплоты для нагревания 1
моля вещества на 1К, чем при постоянном
объеме.
.
В самом деле, при их изохорическом
нагревании работа си-стемой не совершается.
Поэтому все подводимое тепло, согласно
первому закону термодинамики, идет на
увеличение его внутренней энергии, т.
е. на повышение его температуры. Если
же давление системы при нагревании
остается постоянным, то она должна
расширяться (иначе давление будет
расти), совершая внешнюю работу. В этом
случае не все тепло, подводимое к системе,
идет на изменение внутренней энергии,
а часть этого тепла затрачивается на
совершение работы. Следовательно, при
постоянном давлении требуется большее
количество теплоты для нагревания 1
моля вещества на 1К, чем при постоянном
объеме.
Как мы знаем, внутренняя
энергия веществ, не подвергнутых действию
внешних полей, является функцией двух
переменных
![]() :
зависимость от температуры учитывает
суммарную кинетическую энер-гию молекул,
а от объема – суммарную потенциальную
энергию их взаимодействия.
:
зависимость от температуры учитывает
суммарную кинетическую энер-гию молекул,
а от объема – суммарную потенциальную
энергию их взаимодействия.
Подставляя приращение внутренней энергии
(2.5.9)
в выражение (2.3.9), получим
 . (2.5.10)
. (2.5.10)
Подставив количество теплоты (2.5.10) в (2.5.1), получим
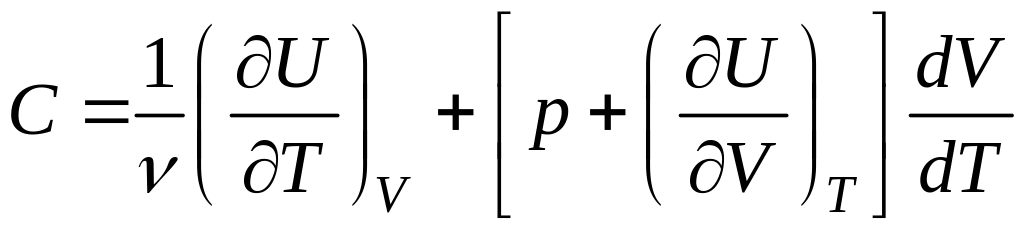 . (2.5.11)
. (2.5.11)
Откуда находим теплоемкости при постоянном объеме и постоянном
давлении
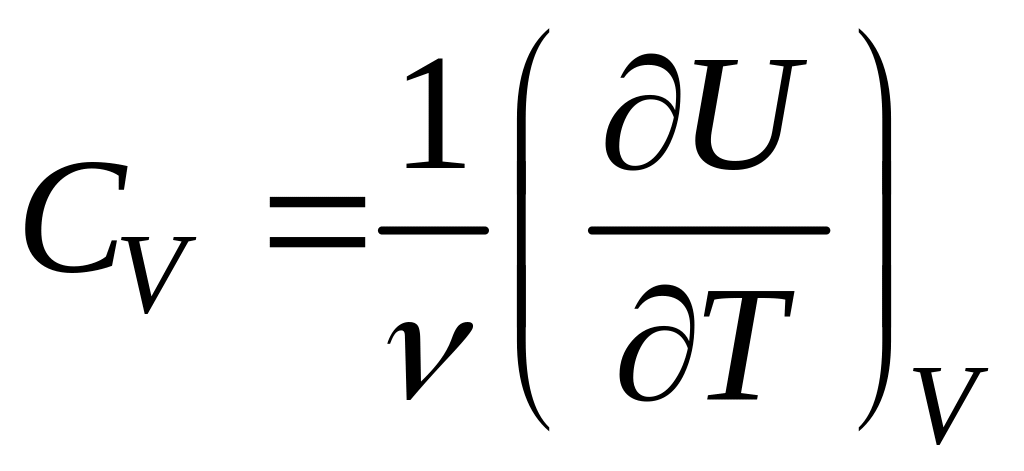 , (2.5.12)
, (2.5.12)
 . (2.5.13)
. (2.5.13)
Как видно из выражений
(2.5.12–2.5.13), для нахождения
и
![]() необходимо располагать явным видом
двух функций:
необходимо располагать явным видом
двух функций:
![]() – внутренней энергии и
– внутренней энергии и
![]() – уравнением состояния вещества.
Указанные функции не могут быть найдены
теоретически методами термодинамики;
их заимствуют либо из статистической
теории, либо определяют опытным путем.
Для идеального газа эти функции нам
известны (2.2.4; 1.9.3):
– уравнением состояния вещества.
Указанные функции не могут быть найдены
теоретически методами термодинамики;
их заимствуют либо из статистической
теории, либо определяют опытным путем.
Для идеального газа эти функции нам
известны (2.2.4; 1.9.3):
![]() , (2.5.14)
, (2.5.14)
![]() . (2.5.15)
. (2.5.15)
Подставив (2.5.14–2.5.15) в (2.5.12–2.5.13), получим
![]() , (2.5.16)
, (2.5.16)
![]() . (2.5.17)
. (2.5.17)
Таким образом, для идеального
газа теплоемкость при постоянном
давлении больше теплоемкости при
постоянном объеме на величину
![]() ,
которая численно равна работе при
изобарическом нагревании 1 моля идеального
газа на 1К.
Для отношения теплоемкостей получим
,
которая численно равна работе при
изобарическом нагревании 1 моля идеального
газа на 1К.
Для отношения теплоемкостей получим
 . (2.5.18)
. (2.5.18)
Из формул (2.5.16–2.5.17) видно, что теплоемкости и для идеального газа не зависят от температуры. Значения теплоемкостей, полученные из формул (2.5.16–2.5.17), и экспериментальные данные для одноатомных и многих двухатомных газов почти совпадают (в случае двухатомных газов лишь при температурах не очень сильно отлича-ющихся от комнатной). Для трехатомных и многоатомных газов различие между теоретическими и опытными данными теплоемкостей весьма существенны. Эти расхождения могут быть устранены лишь с помощью квантовой теории.
В заключение этого параграфа
отметим, что теплоемкость является
положительной величиной
![]() ,
если при получении тепла
система разогревается
,
если при получении тепла
система разогревается
![]() и, наоборот, если система, отдавая тепло
и, наоборот, если система, отдавая тепло
![]() ,
охлаждается
,
охлаждается
![]() .
Однако теплоемкость может быть и
отрицательной
.
Однако теплоемкость может быть и
отрицательной
![]() .
Это, как видно из формулы (2.5.1), наблюдается
в двух случаях:
.
Это, как видно из формулы (2.5.1), наблюдается
в двух случаях:
при получении тепла система охлаждается ,
при отдаче тепла система разогревается .
Оба случая легко объясняются при помощи первого закона термоди-намики, записанного в следующем виде:
![]() . (2.5.19)
. (2.5.19)
В первом случае газ производит
работу расширения
в количестве большем, чем количество
теплоты
![]() ,
которое подводится к газу в процессе
расширения
,
которое подводится к газу в процессе
расширения
![]() .
В этом случае на производство работы
помимо тепла, подведенного к газу,
расходуется и некоторое количество его
внутренней энергии. Хотя к газу и
подводится тепло, но оно целиком
превращается в работу, а убыль внутренней
энергии
.
В этом случае на производство работы
помимо тепла, подведенного к газу,
расходуется и некоторое количество его
внутренней энергии. Хотя к газу и
подводится тепло, но оно целиком
превращается в работу, а убыль внутренней
энергии
![]() газа ведет к снижению температуры.
газа ведет к снижению температуры.
Во втором случае работа,
производимая над газом при его сжатии
![]() ,
оказывается по абсолютной величине
большей, чем количество отдаваемого
им тепла
.
С учетом знаков количества теплоты
,
оказывается по абсолютной величине
большей, чем количество отдаваемого
им тепла
.
С учетом знаков количества теплоты
![]() и работы
равенство (2.5.19) принимает вид:
и работы
равенство (2.5.19) принимает вид:
![]() (2.5.20)
(2.5.20)
где уже
![]() и
и
![]() .
Поэтому в этом случае, как видно из
(2.5.20), внутренняя энергия системы
увеличивается
.
Поэтому в этом случае, как видно из
(2.5.20), внутренняя энергия системы
увеличивается
![]() ,
а значит, ее температура растет, несмотря
на то, что газ отдает теплоту. Подобный
процесс происходит в некоторых звездах:
гравитационные силы при сжатии звезды
совершают работу большую, чем излучаемое
ей тепло, поэтому звезда разогревается,
несмотря на то, что она излучает теплоту.
,
а значит, ее температура растет, несмотря
на то, что газ отдает теплоту. Подобный
процесс происходит в некоторых звездах:
гравитационные силы при сжатии звезды
совершают работу большую, чем излучаемое
ей тепло, поэтому звезда разогревается,
несмотря на то, что она излучает теплоту.
Наконец, обратим внимание
на размерность теплоемкости. В системе
СИ ее размерностью, как видно из формулы
(2.5.1), является
![]()
