
- •Билет№15
- •Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
- •Глицерин – многоатомный спирт; состав молекулы, физические и химические свойства, применение.
- •Опыт. Испытание индикатором растворов солей, образованных а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием. Объясните результаты наблюдений.
- •Билет №16
- •Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
- •Глюкоза – представитель моносахаридов, химическое строение, физические и химические свойства, применение.
- •Применение
- •Задача. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия 0, 05 или 5%.
- •Билет №17
- •Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •Крахмал, нахождение в природе, практическое значение, гидролиз крахмала.
- •3. Строение
- •Опыт. Получить амфотерный гидроксид и провести химические реакции, характеризующие его свойства.
- •Билет №18
- •Общая характеристика подгруппы галогенов, строение атомов, возможные степени окисления, физические и химические свойства.
- •Аминокислоты, их состав и химические свойства: взаимодействие с воляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
- •Задача. Определить объем водорода (н.У.), который необходим для восстановления 128 г меди из оксида меди (II).
Крахмал, нахождение в природе, практическое значение, гидролиз крахмала.
Это белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
6CO2 + 6H2O свет, хлорофилл → C6H12O6 + 6O2
nC6H12O6 → (C6H10O5)n + nH2O
глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
3. Строение
Состоит из остатков α - глюкозы.
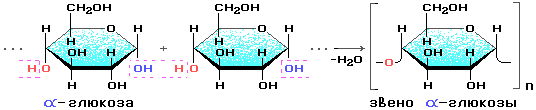
В состав крахмала входят:
· амилоза (внутренняя часть крахмального зерна) – 10-20%
· амилопектин (оболочка крахмального зерна) – 80-90%
Химические свойства полисахаридов
Гидролиз:
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал декстрины мальтоза глюкоза
Качественная реакция:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
· Ценный питательный продукт.
· Для накрахмаливания белья.
· В качестве декстринового клея.
Опыт. Получить амфотерный гидроксид и провести химические реакции, характеризующие его свойства.
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Zn(OH)2↓ - гидроксид натрия
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O – осадок растворился
Zn(OH)2 + NaOH = Na2ZnO2 + 2H2O - осадок растворился
Билет №18
Общая характеристика подгруппы галогенов, строение атомов, возможные степени окисления, физические и химические свойства.
Галогены - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
Молекулы галогенов состоят из двух атомов.
С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3
2Fe + 3F2 = 2FeF3
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2HF
Si + 2F2 = SiF4
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны +1.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3
2Fe + ЗCl2 = 2FeCl3
Si + 2Cl2 = SiCl4
Н2 + Cl2 = 2HCl
