
- •Билет№15
- •Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
- •Глицерин – многоатомный спирт; состав молекулы, физические и химические свойства, применение.
- •Опыт. Испытание индикатором растворов солей, образованных а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием. Объясните результаты наблюдений.
- •Билет №16
- •Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
- •Глюкоза – представитель моносахаридов, химическое строение, физические и химические свойства, применение.
- •Применение
- •Задача. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия 0, 05 или 5%.
- •Билет №17
- •Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •Крахмал, нахождение в природе, практическое значение, гидролиз крахмала.
- •3. Строение
- •Опыт. Получить амфотерный гидроксид и провести химические реакции, характеризующие его свойства.
- •Билет №18
- •Общая характеристика подгруппы галогенов, строение атомов, возможные степени окисления, физические и химические свойства.
- •Аминокислоты, их состав и химические свойства: взаимодействие с воляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
- •Задача. Определить объем водорода (н.У.), который необходим для восстановления 128 г меди из оксида меди (II).
Билет №16
Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
Основания -- вещества, диссоциирующие в водном растворе с образованием катионов металла и гидроксид-анионов ОН−.
Основание -- NaOH:
NaOH ↔ Na+ + OH-
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде:
NH3 + H2O = NH4OH (гидроксид аммония).
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками.
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Щелочами называются растворимые в воде сильные основания.
Свойства, характерные для всех оснований, проявляются благодаря присутствию в их растворах гидроксид- ионов OH-..
Наиболее важное химическое свойство всех оснований – взаимодействие с кислотами – реакция нейтрализации.
NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O
H+ + OH- = H2O
Взаимодействие щелочей с кислотными оксидами.
NaOH + CO2 = Na2CO3
Взаимодействие щелочей с солями, если в результате реакции одно из веществ выпадает в осадок.
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3↓ + 3Na+ + 3Cl-
3OH- + Fe3+ = Fe(OH)3↓
Глюкоза – представитель моносахаридов, химическое строение, физические и химические свойства, применение.
Глюко́за (C6H12O6), или виноградный сахар, или декстроза встречается в соке многих фруктов и ягод, в том числе и винограда, отчего и произошло название этого вида сахара.
Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях, растворимо в реактиве Швейцера: аммиачном растворе гидроксида меди — Cu(NH3)4(OH)2, в концентрированном растворе хлорида цинка и концентрированном растворе серной кислоты.
Глюкоза может существовать в виде циклов (α и β глюкозы).
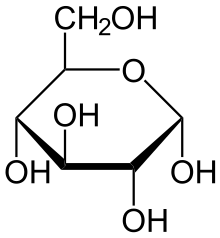
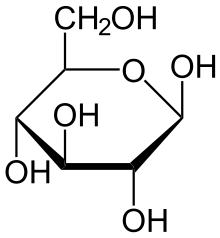
α-глюкоза β-глюкоза
Химические свойства альдегидной формы глюкозы:
Глюкоза – это вещество с двойственной химической природой;
Как альдегид она окисляется. Окислительное действие аммиачного раствора оксида серебра (I) на глюкозу можно записать следующим образом:
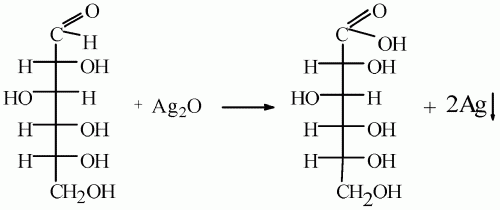
Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH
