
- •Термохімія. Закон Гесса та його застосування
- •2 Основні поняття хімічної термодинаміки. Внутрішня енергія ентальпія 1 закон термодинаміки..
- •3. Ентропія. Змінаентропії у фізичних та хімічних процесах. Іі закон термодинаміки.
- •4. Зміна ізобарного та ізохорного потенціалів в результаті перебігу хімічних процесів.
- •6) Молекулярність та порядок хімічної реакції.
- •7 . Залежність швидкості хімічної реакції від температури
- •8. Енергія активації. Каталіз
- •9. Хімічна рівновага в гомогенних та гетерогенних процесах . Зміщення хімічної рівноваги . Принцип Ле Шательє.
- •11 . Розчини. Закони Рауля
- •12) Осмотичний тиск розчинів. Зворотній осмос.
- •13. Класифікація поверхневих явищ. Поверхнева енергія і поверхневий натяг. Адсорбція.
- •14. Класифікація дисперсних систем
- •16) Міцелярна будова колоїдних розчинів.
- •17. Золі, драглі, тиксотропія.
- •Коагуляція
- •18. Коагуляція. Поріг коагуляції
- •19. Силіцій в природі . Властивості сполук силіцію .
- •23.Діаграми стану двокомпонентної системи з хімічною сполукою, що плавиться конгруентно
- •24. Діаграма стану двокомпонентної системи з хімічною сполукою, що плавиться інконгруентно
Коагуляція
Коагуляція – злипання частинок колоїдів при їхньому зіткненні в процесі теплового (броунівського) руху, перемішування або напрямленого переміщення в зовнішньому силовому полі. У агрегатах (флокулах) первинні частинки пов'язані молекулярними силами безпосередньо або через прошарок навколишнього (дисперсійного) середовища. К. зумовлена агрегативною нестійкістю системи і її тенденцією до зменшення вільної енергії.
Процес, зворотний К., - розпад агрегатів на первинні частинки, або перехід гелю в золь, наз. пептизацією. К. використовують, напр., при флотац. збагаченні руд, очищенні води від природних і побутових забруднень, виділенні цінних пром. продуктів з відходів виробництва, зміцненні водонасичених ґрунтів.
Коагуляція — завершений процес. коагулювання - власне протікання процесу.
18. Коагуляція. Поріг коагуляції
Стійкість колоїдної системи характеризується її здатністю зберігати протягом тривалого часу свої основні параметри: дисперсність і рівноважний розподіл дисперсної фази в дисперсійному середовищі. Лише ліофільні колоїдні системи, що здатні утворюватися шляхом самочинного диспергування, є термодинамічно стійкими. Натомість ліофобні системи є принципово термодинамічно нестійкими. На відміну від молекулярних розчинів (гомогенних систем) колоїдні системи мають великий запас вільної поверхневої енергії, самочинне зниження якої може відбуватися внаслідок зменшення поверхні поділу фаз. Таким чином, процес злипання часток (коагуляція) є термодинамічно вигідним і самочинним.
Коагуляція колоїдних систем відбувається під впливом різних чинників: при введенні електролітів та неелектролітів, внаслідок заморожування, кип’ятіння і перемішування, дії сонячного світла тощо
Основні положення сучасної теорії стійкості були розроблені російськими і голландськими вченими: Дєрягіним, Ландау, Фервєєм і Овербеком, на честь яких вона отримала назву теорії ДЛФО. Згідно з теорією ДЛФО між частками, що знаходяться в тепловому броунівському русі, при їх зближенні виникають дві протилежно направлені сили: відштовхування і молекулярного притягання (сили Ван-дер-Ваальса). Баланс енергій притягання та відштовхування визначає результат зустрічі двох часток дисперсної фази. Взаємодію між частками прийнято характеризувати за допомогою потенціальних кривих – залежностей сумарної енергії взаємодії між частками від відстані між ними (рис. 4.3).
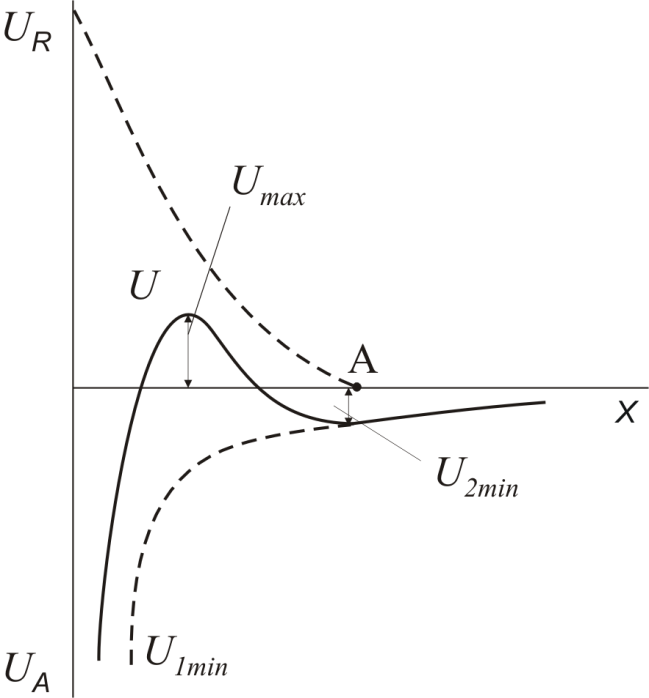
Рис. 4.3. Потенціальні криві взаємодії між частинками
Енергія відштовхування (UR) зменшується з відстанню експоненційно і в точці А, що відповідає початку перекриття дифузних шарів міцел, дорівнює нулю. Енергія притягання (UA) проявляється на відстанях, сумірних з розмірами часток, і зменшується із збільшенням відстані між ними за степеневою залежністю. Потенційні криві можна розрахувати теоретично.
При зближенні міцел енергія їхньої взаємодії U визначається співвідношенням між енергіями відштовхування та притягання і описується кривою U, яка є результатом алгебраїчного додавання потенціальних кривих UR та UA.
Як видно з рис. 4.3, на малих відстанях між частинками (х = 2 – 10 Å) переважає притягання, і на кривій U=f(x) утворюється перший мінімум U1min (перша потенціальна яма). На великих відстанях (х = 100 – 1000 Å) також переважає притягання, оскільки степенева функція зменшується значно повільніше, ніж експоненційна. На потенціальній кривій з’являється другий мінімум U2min (друга потенціальна яма), глибина якого є невеликою.
На середніх відстанях (х = 10 – 100 Å) переважає відштовхування, і на потенціальній кривій U виникає максимум Umax. Цей максимум називається потенціальним бар’єром відштовхування. Висота бар’єру змінюється від 0 до 100 kТ залежно від концентрації електролітів у системі і наявності в ній інших стабілізаторів дисперсної системи.
Висота потенціального бар’єру відштовхування і глибина потенціальних ям визначають здатність часток до агрегації при їхньому зближенні. При цьому можливі такі варіанти:
1. Якщо висота потенціального бар’єру є великою (Umax >> kT), а глибина другого мінімуму є малою (U2min < kT), то в цьому випадку частки не можуть подолати бар’єр і розходяться без агрегації. Такі системи є агрегативно стійкими.
2. У випадку, коли висота потенціального бар’єру є середньою (Umax » kT), частки, що мають значну кінетичну енергію, здатні його подолати і вони злипаються. Одначе не всі зіткнення часток приводять до злипання, тому коагуляція є повільною.
3. Коли висота потенціального бар’єру і глибина другого (дальнього) мінімуму є незначними (Umax < kT, U1min < kT ), частки зближуються за рахунок броунівського руху до найменшої можливої відстані ( » 2 – 10 Å), і енергія системи зменшується на глибину першого (глибокого) мінімуму. Такі системи є нестійкими, при кожному зіткненні частки злипаються, відбувається швидка коагуляція.
4. Якщо величина другого мінімуму є значною (U2min » 5 – 10 kT ), то незалежно від висоти потенціального бар’єру відбувається дальня взаємодія часток на відстанях 100 – 1000 Å. Частки в цьому випадку фіксуються у просторі, взаємодіючи через прошарки рідини і не змінюючи свою індивідуальність і дисперсність. Фіксація часток у другому мінімумі при великих концентраціях дисперсної фази призводить до утворення коагуляційних структур. Вони легко руйнуються при збільшенні температури або внаслідок механічної дії.
Зменшення або повна ліквідація енергетичного бар’єру Umax, висота якого визначається величиною електрокінетичного потенціалу міцел, призводить до коагуляції. Цього можна досягти або за рахунок зменшення термодинамічного потенціалу часток шляхом введення неіндиферентних електролітів в систему (нейтралізаційна коагуляція), або за рахунок стискання подвійного електричного шару за допомогою індиферентних електролітів (концентраційна коагуляція). Неіндиферентні електроліти містять іони, які здатні адсорбуватися на поверхні (одноіменні, ізоморфні та багатозарядні іони). Індиферентні електроліти містять іони, що не здатні адсорбуватись на поверхні (здебільшого однозарядні іони).
Для початку коагуляції необхідно перевищити деяку мінімальну концентрацію електроліту в системі. Ця величина – поріг коагуляції – відповідає такому стисканню ПЕШ, в результаті якого енергетичний бар’єр Umax знижується настільки, що він вже не здатний запобігати злипанню частинок. Дослідним шляхом встановлено та теоретично розраховано, що x = 30 мВ є мінімальним значенням електрокінетичного потенціалу, при якому дисперсна система є стійкою. При x < 30 мВ коагуляція стає можливою.
Швидкість коагуляції – це зменшення частинної концентрації ν за одиницю часу:
|
(4.12) |
