
- •Термохімія. Закон Гесса та його застосування
- •2 Основні поняття хімічної термодинаміки. Внутрішня енергія ентальпія 1 закон термодинаміки..
- •3. Ентропія. Змінаентропії у фізичних та хімічних процесах. Іі закон термодинаміки.
- •4. Зміна ізобарного та ізохорного потенціалів в результаті перебігу хімічних процесів.
- •6) Молекулярність та порядок хімічної реакції.
- •7 . Залежність швидкості хімічної реакції від температури
- •8. Енергія активації. Каталіз
- •9. Хімічна рівновага в гомогенних та гетерогенних процесах . Зміщення хімічної рівноваги . Принцип Ле Шательє.
- •11 . Розчини. Закони Рауля
- •12) Осмотичний тиск розчинів. Зворотній осмос.
- •13. Класифікація поверхневих явищ. Поверхнева енергія і поверхневий натяг. Адсорбція.
- •14. Класифікація дисперсних систем
- •16) Міцелярна будова колоїдних розчинів.
- •17. Золі, драглі, тиксотропія.
- •Коагуляція
- •18. Коагуляція. Поріг коагуляції
- •19. Силіцій в природі . Властивості сполук силіцію .
- •23.Діаграми стану двокомпонентної системи з хімічною сполукою, що плавиться конгруентно
- •24. Діаграма стану двокомпонентної системи з хімічною сполукою, що плавиться інконгруентно
14. Класифікація дисперсних систем
Дисперсною називають систему, в якій одна або декілька речовин подрібнені і розподілені в іншій речовині
Дисперсна фаза - речовина, що утворює дискретну частину дисперсної системи
Дисперсійне середовище - речовина, що утворює суцільну частину дисперсної системи

Класифікація дисперсних систем за розміром частинок дисперсної фази
r > 100 нм - грубодисперсні системи (механічні суміші);
1 < r < 100 нм - тонкодисперсні системи (колоїди);
r < 1 нм - істині розчини.
Концентрація розчинів
Масова частка (w)
w = m2/ m, де m2 - маса розчиненої речовини, m - маса розчину
Молярність (CM)
CM = n2/V, де n2 - кількість розчиненої речовини, V - об'єм розчину, одиниця виміру моль/л (М).
16) Міцелярна будова колоїдних розчинів.
Міцели – скупчення правильно розміщених молекул, асоціація в агрегати молекул, які втримуються переважно дисперсійними силами. Кожна міцела є асоційованою частинкою дисперсної фази золю, яка включає також подвійний електричний шар і сольватні оболонки; існує в рівновазі з молекулами та йонами, які її утворюють (напр., поверхнево-активні речовини в розчинах).
В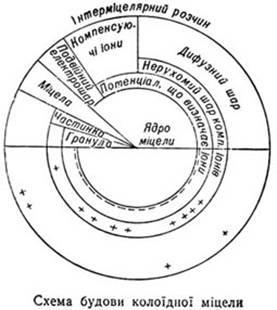 важається,
що колоїдний розчин складається з міцел,
які утворюються зарядженими колоїдними
частинками. Заряд виникає внаслідок
вибіркової адсорбції іонів на поверхні
частинок, або за рахунок іонізації
поверхневих функціональних груп твердої
фази. В міцелі розрізняють три складових
частини: ядро, адсорбційний шар іонів
і дифузійний шар іонів. Ядро складає
основну масу міцели і є сукупністю
нейтральних атомів або молекул, загальною
кількістю сотні та мільйони одиниць.
На ядрі адсорбуються іони (вибіркова
адсорбція) які надають йому певного
заряду, тому їх називають
потенціало-утворюючими. Потенціал, що
виникає на ядрі, отримав ще назву
електротермодинамічного і він обумовлює
подальше приєднання до отенціал-утворюючих
іонів деякої кількості інших іонів з
протилежним знаком заряду. Такий
подвійний електричний шар,
потенціало-утворюючих іонів, разом з
протиіонами (іонами з протилежним
знаком) складає адсорбційний шар іонів.
Частина протиіонів є слабко зв`язаними
з потенціало-утворюючими іонами й вільно
переміщується в розчиннику, формуючи
дифузійний шар. Ядро разом з адсорбційним
і дифузійним
важається,
що колоїдний розчин складається з міцел,
які утворюються зарядженими колоїдними
частинками. Заряд виникає внаслідок
вибіркової адсорбції іонів на поверхні
частинок, або за рахунок іонізації
поверхневих функціональних груп твердої
фази. В міцелі розрізняють три складових
частини: ядро, адсорбційний шар іонів
і дифузійний шар іонів. Ядро складає
основну масу міцели і є сукупністю
нейтральних атомів або молекул, загальною
кількістю сотні та мільйони одиниць.
На ядрі адсорбуються іони (вибіркова
адсорбція) які надають йому певного
заряду, тому їх називають
потенціало-утворюючими. Потенціал, що
виникає на ядрі, отримав ще назву
електротермодинамічного і він обумовлює
подальше приєднання до отенціал-утворюючих
іонів деякої кількості інших іонів з
протилежним знаком заряду. Такий
подвійний електричний шар,
потенціало-утворюючих іонів, разом з
протиіонами (іонами з протилежним
знаком) складає адсорбційний шар іонів.
Частина протиіонів є слабко зв`язаними
з потенціало-утворюючими іонами й вільно
переміщується в розчиннику, формуючи
дифузійний шар. Ядро разом з адсорбційним
і дифузійним
шарами іонів і складає міцелу, яка в цілому є електронейтральною (тоді як сама колоїдна частинка несе певний заряд).
17. Золі, драглі, тиксотропія.
Золі– дисперсні системи, найдрібніші частинки будь-якої речовини в рідкому (гідрозолі), твердому чи газоподібному (аерозолі) середовищі. Золі ще називають “колоїдними розчинами”. З. з водним середовищем називають гідрозолями, з органічним середовищем - органозолями. Частинки дисперсної фази З. (міцели) беруть участь у броунівському русі. При коагуляції ліофобні З., для яких характерна слабка взаємодія частинок з середовищем, перетворюються в гелі. Твердими З. називають дисперсні системи з розподіленими у твердій фазі тонкими частинками іншої твердої фази.
Золі поділяються на:
Тверді золі - дорогоцінні камені
Аерозолі
Ліозолі
Ліозолі поділяються на:
Гідрозолі- середовище вода
Алкозолі- середовище спирт
Органозолі- середовище органічні рідини
Тиксотро́пія (від грец. τύχης — дотик і грец. τροπή — поворот, зміна) — здатність деяких структурованих дисперсних систем мимоволі відновлювати зруйновану механічною дією початкову структуру. Тиксотропія виявляється в розрідженні при достатньо інтенсивному струшуванні або перемішуванні гелів, паст, суспензій та ін. систем з коагуляційною дисперсною структурою та їх загущенні (твердінні) після припинення механічної дії.
Тиксотропне відновлення структури — механічно оборотний ізотермічний процес, який може бути відтворений багато разів. У ширшому сенсі тиксотропія — тимчасове пониження ефективної в'язкості в'язко-текучої або пластичної системи в результаті її деформації незалежно від фізичної природи змін, що відбуваються в ній.
Значення і застосування
Тиксотропія має важливе практичне значення. Тиксотропні матеріали використовують в технології силікатів, пластичних мас, харчових продуктів. Тиксотропні властивості мають деякі водоносні ґрунти (пливуни), біологічні структури, різні технічні матеріали (промивальні глинисті розчини, вживані при бурінні нафтових свердловин, фарби, мастила і ін.).
Драглі
Ліоге́ль (драглі) (рос. лиогель (студень); англ. lyogel; нім. Lyogel n) — структуровані системи полімер-розчинник, що утворюються при сильному набряканні зшитого полімеру; відтак, це багатий на рідину гель, якому притаманні великі оборотні деформації завдяки скріплювальним структуру лабільним зв'язкам між частинками.
