
- •Химический состав воздуха в % на уровне моря при температуре 15 °c и давлении 101325 Па.
- •Лекция № 2.
- •Лекция № 3. Парциальные мольные величины. Уравнение Гиббса-Дюгема. Экспериментальные методы определения и вычисления парциальных мольных величин.
- •Графические методы. А) Метод отрезков
- •Лекция № 4
- •Лекция № 5
- •Зависимость осмотического давления раствора сахарозы от концентрации:
- •Лекция № 6
- •Лекция № 7
- •Лекция 8. Растворы газов в жидкостях. Факторы, влияющие на растворимость газов в жидкостях. Зависимость растворимости газов от температуры и давления. Методы удаления растворенных газов.
- •3Аконы Вревского.
- •Лекция 10
- •Перегонка с водяным паром
- •Закон распределения Шилова-Нернста
- •Применение закона распределения
Перегонка с водяным паром
Поскольку полной давление пара в системе из двух несмешивающихся жидкостей больше давления пара каждого из его компонентов, то
температура, при которой кипит смесь нерастворимых друг в друге жидкостей, ниже температуры кипения каждого из ее компонентов.
Н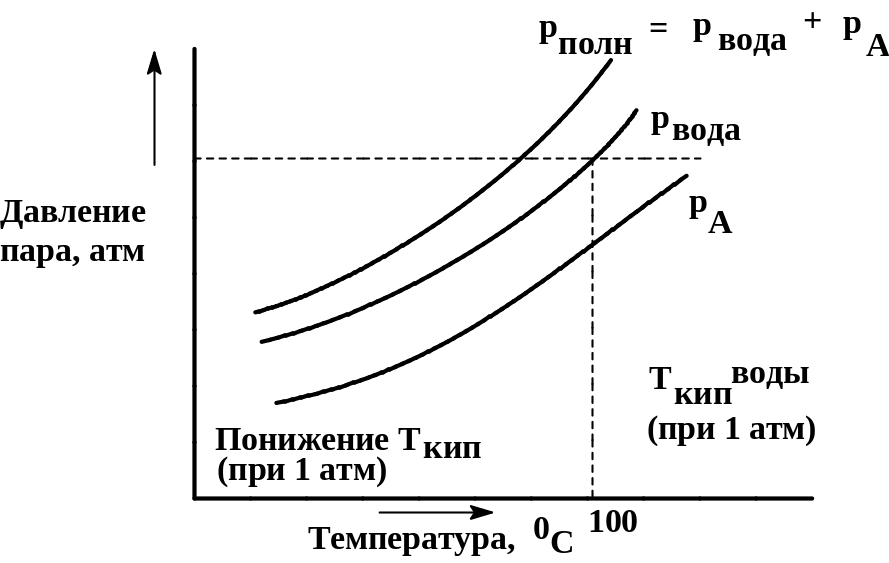 а
этом основана перегонка с паром. При
давлении 1 атм вода имеет температуру
кипения 100оС.
Однако, если пропускать пара через
жидкость, с которой вода не смешивается,
то давления пара увеличивается. Вследствие
этого смесь кипит при пониженной
температуре (рисунок 2).
а
этом основана перегонка с паром. При
давлении 1 атм вода имеет температуру
кипения 100оС.
Однако, если пропускать пара через
жидкость, с которой вода не смешивается,
то давления пара увеличивается. Вследствие
этого смесь кипит при пониженной
температуре (рисунок 2).
Рис. 2 Кривые давления пара для двух несмешивающихся жидкостей
Перегонка с водяным паром используется в следующих целях:
1) для очистки таких жидкостей, как нитробензол или фениламин, которые имеет высокую температуру кипения. Перегонка при низких температурах устраняет риск термического разложения жидкостей;
2) для экстрагирования растительных масел, например, в парфюмерной промышленности.
В настоящее время предпочитают перегонку при пониженном давлении или вакуумную перегонку.
Вычисление молекулярной массы с помощью перегонки с водяным паром:
Молекулярную массу жидкости А, несмешивающейся с водой, можно вычислить на основании данных, полученных в результате ее перегонки с паром.
рА = хАрполн
рводы = хвода рполн
рА/рводы = хА/хводы
Поскольку
хA = nA/(nA+nводы), то
рA/pводы = (mA/MA)/(mводы/Mвода)
Это уравнение позволяет вычислить молекулярный вес жидкости А, поскольку давления паров воды известны для всех температур, а давление паров А можно вычислить вычитая из общего давления (при нормальных условиях - 1 атм) давление паров воды при температуре перегонки.
Закон распределения Шилова-Нернста
Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то при его растворении в смеси двух таких жидкостей оно само распределяется между ними. Отношение, в котором происходит это распределение, называется законом распределения. Этот закон утверждает, что растворимое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества.
Закон распределения основан на экспериментальном наблюдении. Рассмотрим, например, распределение иода между двумя несмешивающимися жидкостями: водой и четыреххлористым углеродом.
К = [I2(CCl4)]/[I2(водн.)]
К - коэффициент распределения.
При 25оС значение постоянной К для рассматриваемого равновесия равно 85, что означает, что концентрация иода в ССl4 в 85 раз больше, чем в воде. Столь большое различие объясняется тем, что иод является неполярным веществом и гораздо лучше растворим в неполярных средах. Для системы вода-бензол К вообще равен 400!
При постоянной температуре отношение равновесных концентраций растворенного вещества, распределенного между двумя несмешивающимися жидкостями (фазами), является величиной постоянной, не зависящей от общего количества компонентов.
КН (Х) = с(Х)/с(Х)
Закон распределения может быть выведен из термодинамических соображений:
Химический потенциал растворяемого вещества 3 в жидкости 1
31=031 + RTlnc31
а во второй жидкости:
32=032 + RTlnc32
При равновесии:
31=32
031 + RTlnc31 = 032 + RTlnc32
Потенциируя: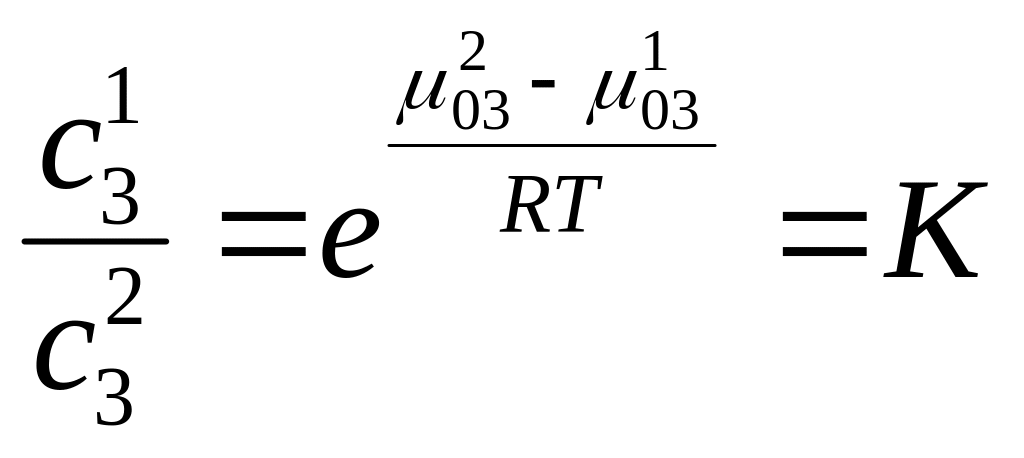
Закон распределения выполняется лишь при определенных условиях:
1) при постоянной температуре;
2) при достаточном разбавлении обоих растворов;
3) при условии, что растворенное вещество не реагирует, не диссоциирует и не ассоциирует в обоих растворителях.
Например, коэффициент распределения для бензойной кислоты и воды возрастает при повышении концентрации в обоих слоях. Это обусловлено образованием димеров бензольной кислоты в слое бензола из-за возникновения водородных связей.
Закон экстракции, впервые установленный Бертло и Юнгфлейшем (1872 г.) для распределения галогенов между водой и сероуглеродом. Если молекулы распределяемого вещества 3 подвергаются ассоциации во второй жидкости 2, и не ассоциируют в первой жидкости 1, то как показал Нернст, закон распределения следует выражать:
К = c31/(c32)n
Где n = число молекул в ассоциате.
Для неидеальных растворов вместо концентраций необходимо пользоваться активносями аi.
